脳梗塞の病型分類はTOAST分類が最も有名で、実臨床ではこのうち分類不能:潜因性脳梗塞(cryptogenic stroke)に該当することが多いことが臨床医にとっては問題でした。そして更に分類するために2014年Lancet Neurology誌で報告された分類概念がESUS(Embolic stroke of undetermined source)です(Lancet Neurol 2014; 13: 429–38)。私も先日ご教授いただき初めて理解したのですが、このESUSという概念はあくまでも「DOACの臨床試験をすすめるための概念」という側面が大きく、実臨床で本当にこの概念を運用するべきかは別の問題であるという点に注意が必要です。
1:ESUS 提唱元文献の定義 Lancet Neurol 2014; 13: 429–38
1:診断基準
・画像上非ラクナ梗塞である(病変の最大径がCTで1.5cm以上 or MRIで2.0cm以上のもの)
・責任血管の狭窄(50%以上)を認めない
・心臓由来の塞栓源を認めない(permanent/paroxysmal AF、持続性AFL、心内血栓、人工弁、心臓腫瘍、僧帽弁狭窄症、4週間以内の心筋梗塞、左室EF<30%、弁の疣贅(感染性心内膜炎))
・他の特殊な原因がない(動脈炎、動脈解離、片頭痛/血管攣縮、薬剤)
2:必要な検査
・頭部CTまたはMRI検査
・経胸壁心エコー検査
・24時間以上の心電図モニター
・頭蓋内/外の血管評価のための画像検査
*このようにESUS診断に必要な検査は「最低限」になっており、経食道心エコーは必要なしとされています。
3:ESUSの原因
・潜因性心房細動:おそらく原因として最多→埋め込み型ループレコーダー
・大動脈原性→経食道心エコー検査
・右左シャント:心内シャント(PFO、ASD)、心外シャント(肺動静脈婁) *右左シャントに関してはこちらにまとめがあるのでご参照ください。→経食道心エコー
・悪性腫瘍関連
2:ESUSに関する臨床試験
冒頭にも申し上げましたが、ESUSという概念は「DOACの臨床試験をすすめるために作られた概念」という要素が大きく、実臨床の原因不明脳梗塞のアプローチとはやや解離があります。ここでこのESUSという概念を導入して行われた大規模臨床試験を紹介します。
*参考:ESUSに関するDOACを検討した臨床試験
・NAVIGATE ESUS(New Approach Rivaroxaban Inhibition of Factor Xa in a Global Trial versus ASA to Prevent Embolism in Embolic Stroke of Undetermined Source): N Engl J Med 2018;378(23): 2191 – 2201. リバロキサバン vs アスピリン:塞栓症再発には有意差なく、出血合併症がリバロキサバン群で有意に多い結果。
・RE-SPECT ESUS (Dabigatran Etexilate for Secondary Stroke Prevention in Patients With Embolic Stroke of Undetermined Source): Int J Stroke 2015;10(8):1309 – 1312. :ダビガトラン vs アスピリン:塞栓症再発には有意差なし。
これらの結果、ESUSという概念を用いてDOACにより再発予防を行うということは有用でないことが分かりました。現状はESUSに関しては再発予防は抗血栓薬を使用します。これらの結果を踏まえてそもそもESUSという概念は不要なのではないかという流れがあります(”It’s Time to Say Goodbye to the ESUS Construct.”Front Neurol. 2020 Jul 7;11:653. doi: 10.3389/fneur.2020.00653. こちらの論文はI先生にご教授いただきました)。つまり実臨床では当たり前ですが純粋に原因不明の脳梗塞として各種検査を行い原因を検索していくアプローチが必要ということです。以下では原因不明の脳梗塞に関して行うべき検索、再発予防などに関してまとめていきます。
3:原因不明の脳梗塞に関する検査
下図は先ほどの文献(”It’s Time to Say Goodbye to the ESUS Construct.”Front Neurol. 2020 Jul 7;11:653. doi: 10.3389/fneur.2020.00653.)では内頚動脈プラークからのA to A機序、大動脈プラーク由来の機序、PFO由来の機序、悪性腫瘍関連(NBTEや凝固障害によるもの)を検索したうえでそれでも原因が指摘できない場合に”Cryptogenic stroke”と表現するべきとしています。
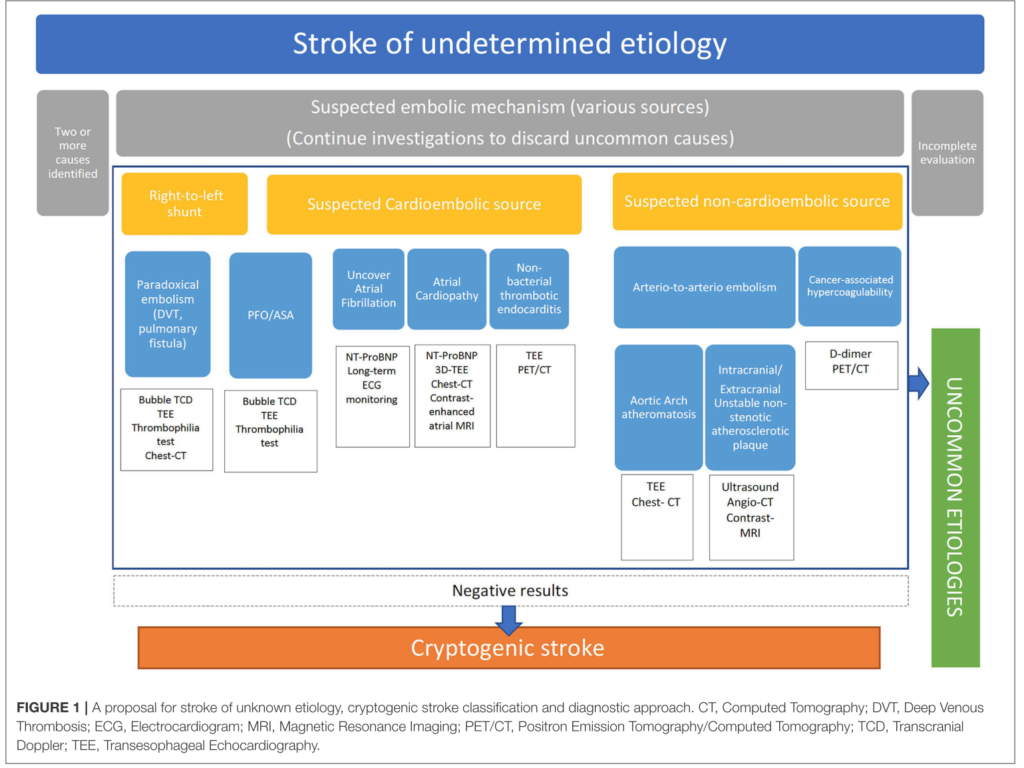
■経食道心エコー検査(TEE: transesophageal echo)
・右左シャント(microbubble test)、大動脈のプラークや潰瘍評価(大動脈原性)のために必要な検査です(こちらにまとめがあります)。感染性心内膜炎のvegetation評価でも有用です(もちろん血液培養検査も必要)。
*よく大動脈原性の診断を造影CTの大動脈で行う先生がいらっしゃいますが、個人的にはTEEの方が可動性のあるプラークがあるか?潰瘍があるか?がより評価しやすくTEEの方が優れていると考えます。
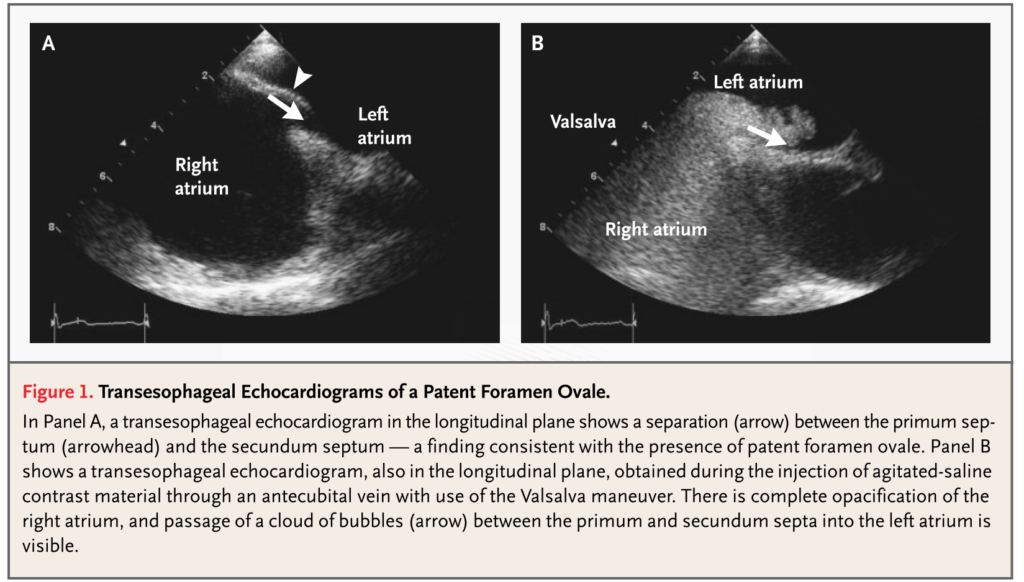
・左心耳血栓や左心耳の血流、形態を評価することも可能です(左心耳に関してはこちらにまとめがあるのでご参照ください)。
■埋め込み型ループレコーダー(ILR: inplantable loop recorder)
・潜因性心房細動を検出するために必要な検査です。元々は失神に対して不整脈検出目的に導入されたものですが、近年原因不明の脳梗塞に対しても適応が通りました。
・手技自体は簡単で私も自分で埋め込むことがありますが、局所麻酔で簡単に入れることが出来るデバイスでUSBくらいの大きさです。下図はメドトロニック株式会社のホームページ(https://www.medtronic.com/jp-ja/healthcare-professionals/products/cardiac-rhythm/icm.html)から引用しました。

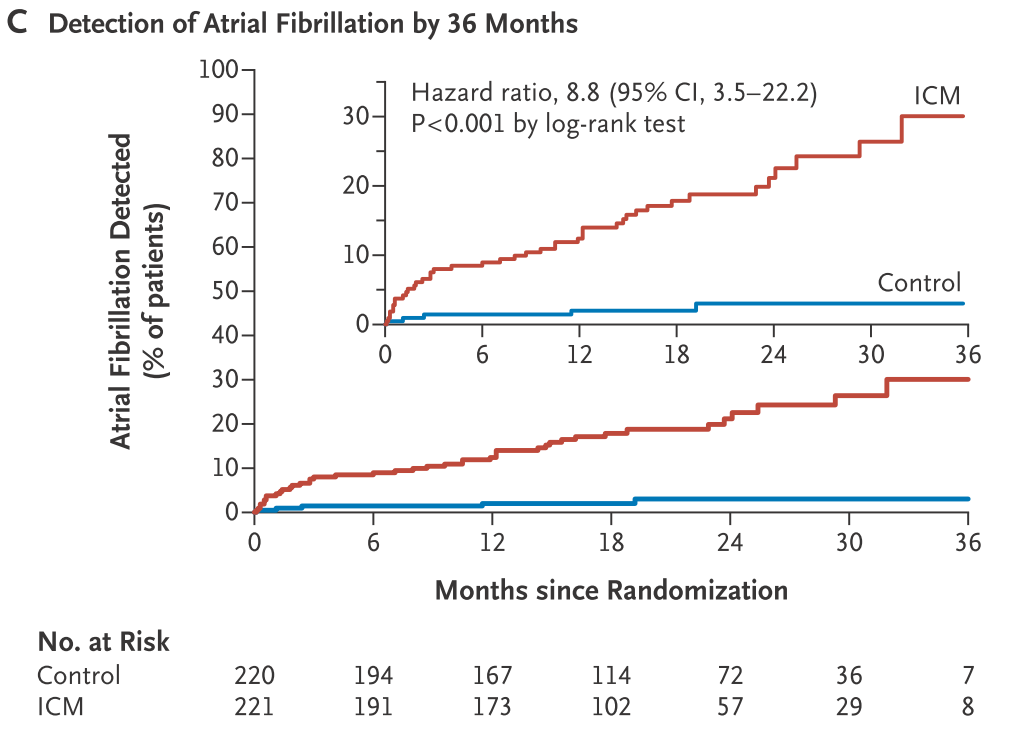
*参考:ILRの有用性を示唆する臨床研究”CRYSTAL-AF” NEJM 2014;370:2478
背景:原因不明脳梗塞の原因として心房細動5-20%指摘されている(当時のguideline上は脳梗塞患者において心電図monitorを24時間継続するようにされている)→それ以上の期間継続する必要性に関しては言及されておらず、各医師にゆだねられている現状があり、明確にどの期間monitorを継続する必要があるかどうかは決まっていない。
design:RCT, IIT解析
Patient:脳梗塞患者441人 多施設55施設、Europe,Canada,Ameria 2009-2012
inclusion:40才以上、90日以内の脳梗塞、原因不明
exclusion:Af既往にあり、抗凝固の禁忌患者
(患者背景まとめ)61才、PFO22%、NIHSS=1.7点、糖尿病15.4%、脂質異常症56.6%、喫煙20%、CAD5%、抗血栓薬95.9%
Intervention:ILR挿入群
Control:control群
Outcome:primary outcome:6か月以内のAF検出*Af>30sec以上持続と定義
・6か月以内のAF検出:8.9% vs 1.4% HR:6.4*
・12か月以内の検出:12.4% vs 2.0% HR:7.3*
*ILRによりAFを検出できる割合(何人にILRを埋め込むと新規心房細動を検出することができるか?)6か月:14人、12か月:10人、36か月:4人
副作用:感染症2.4%
ILR挿入継続(非脱落)6か月後:98.1%, 12か月後:96.6%
4:再発予防
(A) 抗血栓薬:原因に合わせた薬剤の選択
・原因不明の場合:アスピリン *今まで抗凝固薬がより再発を抑制した根拠は得られていない。
・悪性腫瘍関連のTrousseau症候群場合:未分画ヘパリン
・感染性心内膜炎:手術(抗凝固薬は禁忌) 感染性心内膜炎での神経合併症に関してはこちらにまとめがあるのでご参照ください。
・PFOを介した奇異性塞栓症:抗凝固薬(背景の深部静脈血栓症に準ずる)
(B) PFOに関して
・PFOは生理的に開存している人が一定数いることが知られており、「PFOの存在≠奇異性塞栓症」という点に注意が必要です。つまりPFOがあるだけでは脳梗塞のリスクとして不十分であり、よりPFOが原因らしいか?の評価が重要になります。
*PFOの構造としてのrisk factors:separation(4mm以上)、安静時の右左シャント血流、心房中隔の可動性良好、心房中隔瘤(ASA:atrial sepral aneurysm)
*その他のrisk factors:静脈血栓症、外傷、最近の手術、経口避妊使用、凝固能亢進
・このことからわかるように「とりあえずPFOを閉鎖すればよいか?」というとその様な訳でもありません。PFO閉鎖に関しては近年デバイスの進化とともにカテーテル治療により閉鎖することが可能になっています(下図:N Engl J Med 2005;353:2361-72.)。
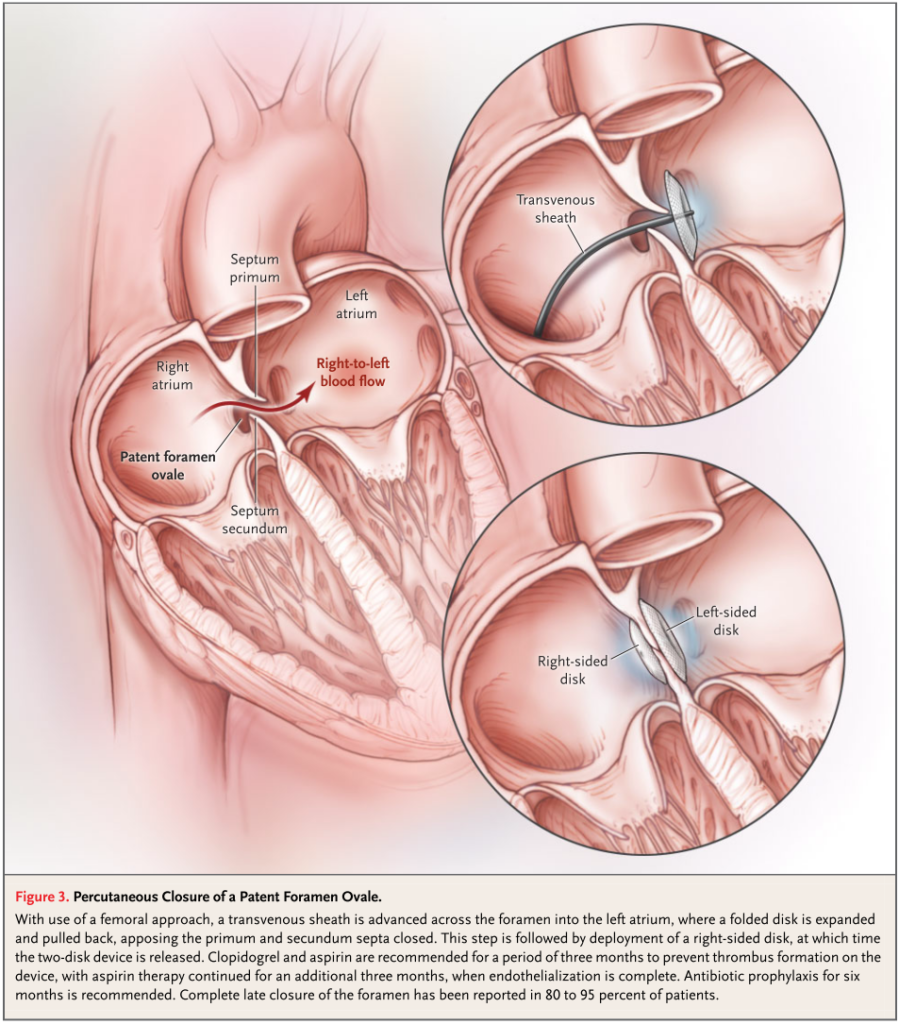
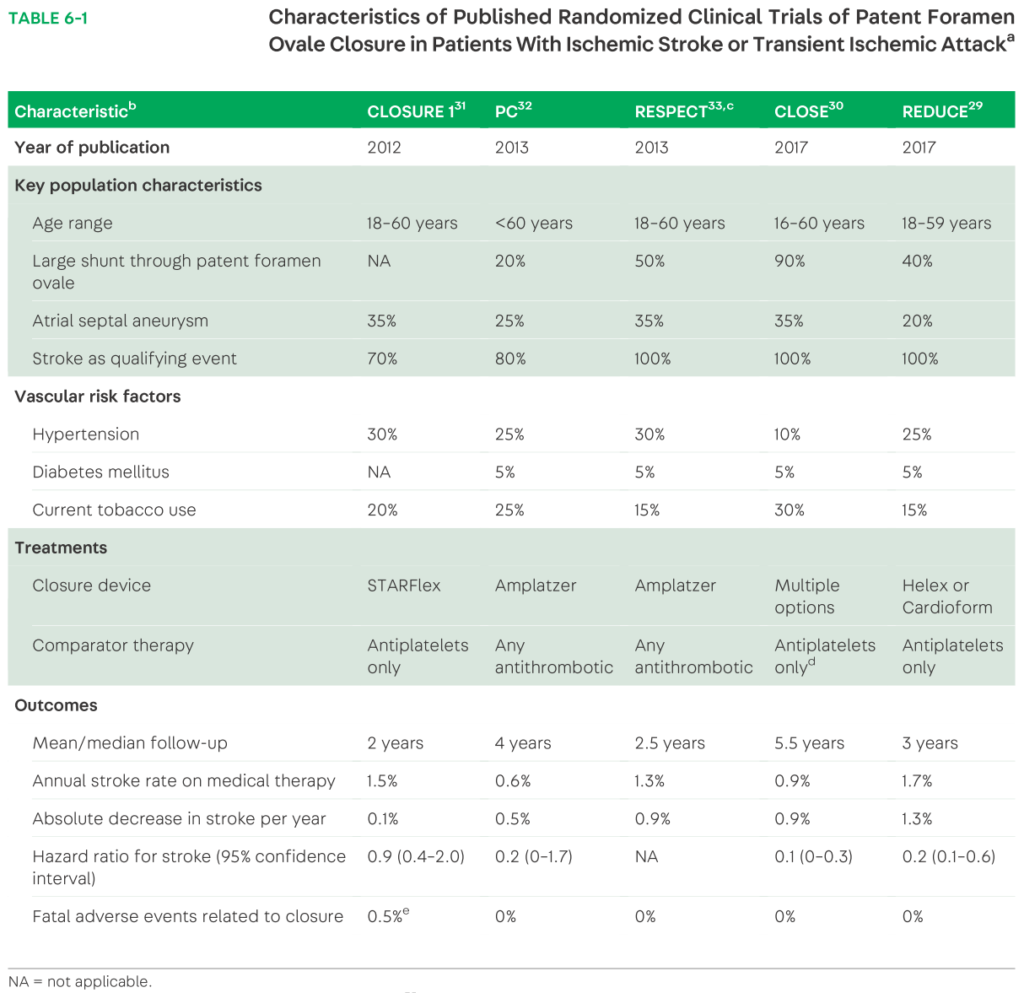
・以下が過去に行われたPFO閉鎖による脳梗塞再発予防の臨床試験のまとめです(CONTINUUM (MINNEAP MINN) 2020;26(2, CEREBROVASCULAR DISEASE):353 – 362.)。現状は個別ごとのケースでリスク評価を行い循環器科Drと相談し薬剤予防とするのかPFO閉鎖術をするのかを検討する流れになると思います。
(C)左心耳閉鎖に関して これらに関してもこちらにまとめがあるのでご参照ください。
・開胸の心臓手術時に同時に行われることが多いのが左心耳閉鎖術です。embolic sourceとなる左心耳をそもそも外科的に閉鎖してしまう方法です。
・近年は胸腔鏡下での左心耳縫縮術を実施されている施設もあり、これは低侵襲で期待が持たれます。
・またカテーテルデバイスによる左心耳閉鎖も近年行われています。
参考文献
・CONTINUUM (MINNEAP MINN) 2020;26(2, CEREBROVASCULAR DISEASE):353 – 362.
・N Engl J Med 2005;353:2361-72.
管理人記録:2021/7/17 ESUSという概念のそもそも論に関してと、今後に関してご教授いただいた点を踏まえて改訂


