病態
・末梢神経の髄鞘もしくは軸索の抗原に対して自己抗体が産生されることで末梢神経障害・神経根障害をきたすことがギラン・バレー症候群(Guillain Barre syndrome: GBS)の病態です。
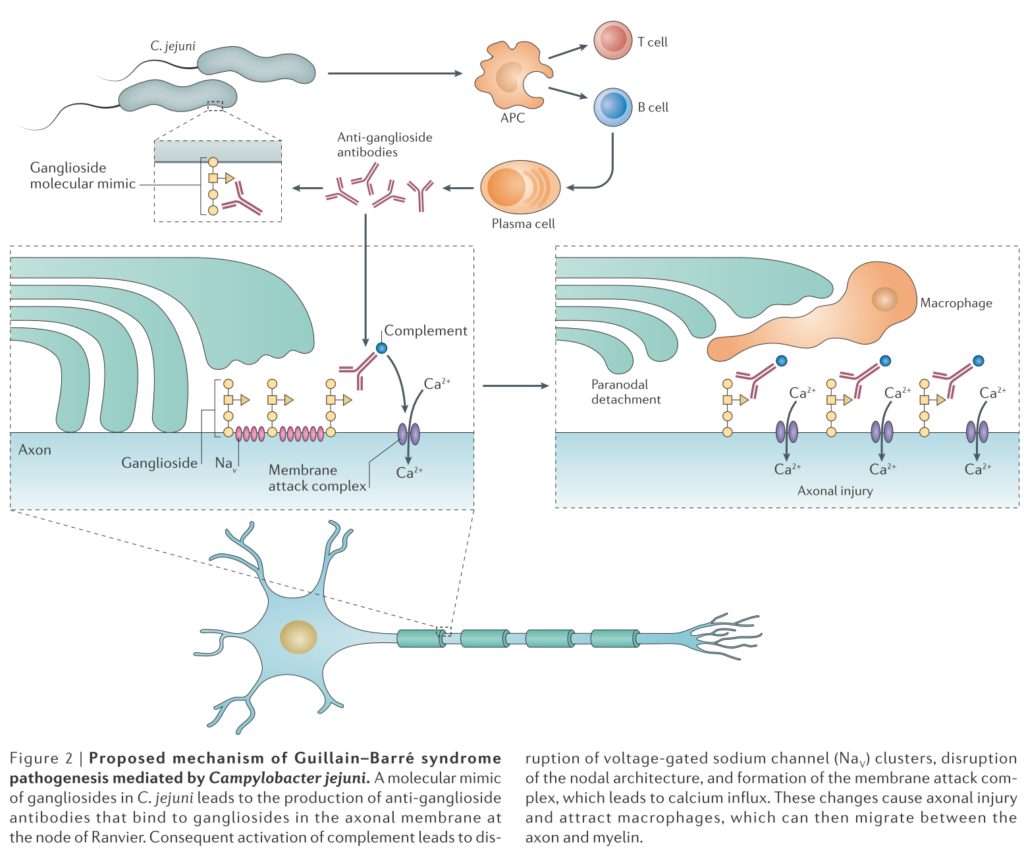
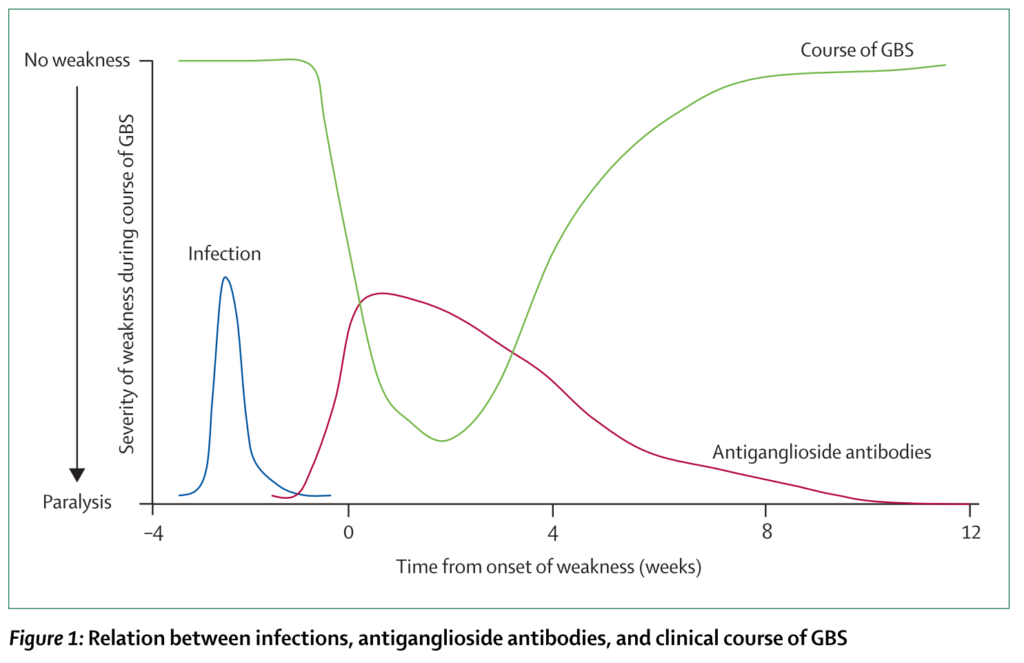
・想定されている病態機序が下図にまとめられています(Nat Rev Neurol. 2016;12(12):723-731.)。全体の約2/3に先行感染(関連のある病原体:Campyrobacter jejuni最多, CMV, EBV, HEV, Mycoplasma pneumoniae, Zika virus)を認めるとされています。病原体と病型はおおまかに細菌は軸索型、ウイルスは脱髄型の対応関係があります。
1:Campyrobacter jejuniの表面分子(ガングリオシドと似た)に対して抗体が産生され、それが末梢神経のnodeに位置するガングリオシドを抗原とした抗原抗体反応が起こります。末梢神経のparenodeの部分でマクロファージが侵入しミエリンの離開を引き起こし、Naチャネル障害によりまず伝導障害が起こります。
2:次に抗体は補体を活性化し、MAC(membrane attack complex)形成による軸索細胞膜の破壊されます。この段階まで進んでしまうと軸索障害の改善が遅くなります。
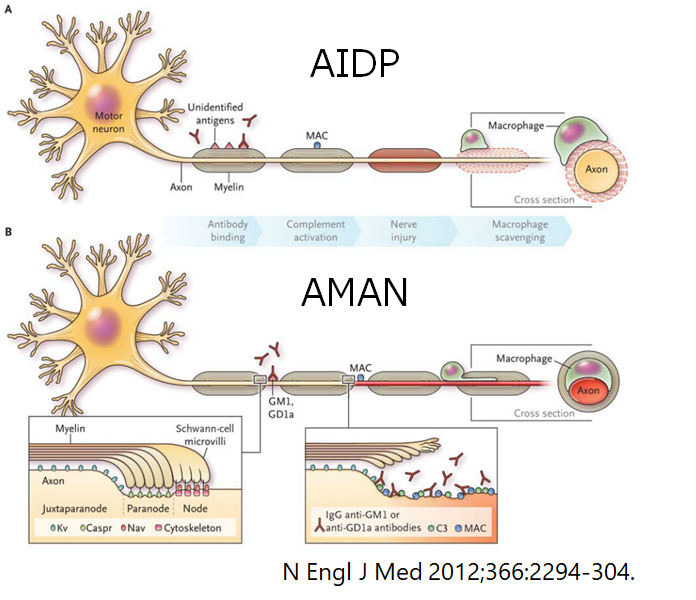
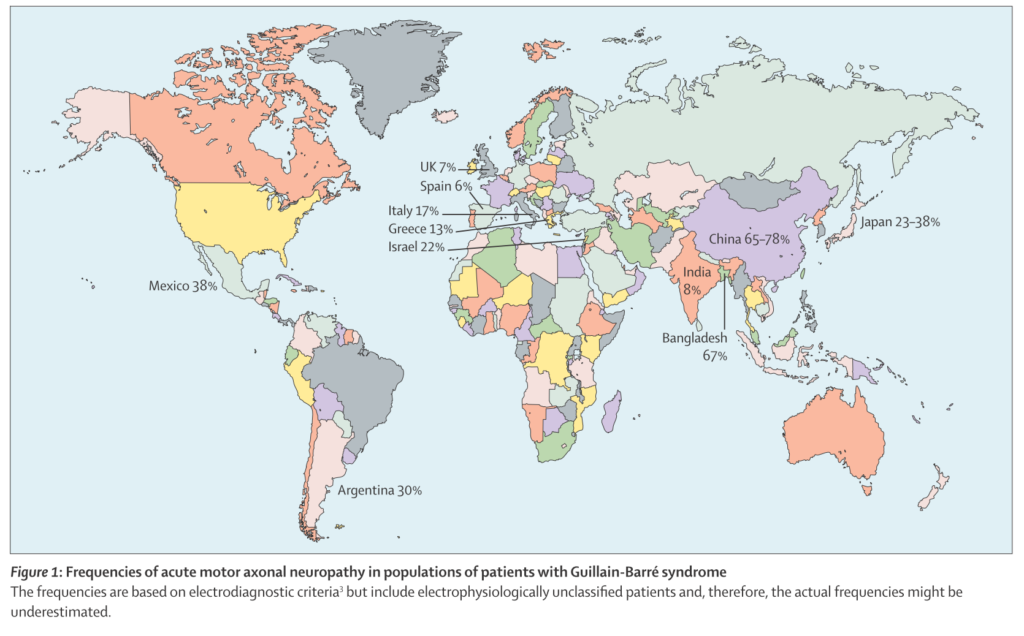
・AMANとAIDPに関しては世界の地域ごとに疫学の差があり、ヨーロッパ系ではAIDPが主体で、アジアなどではAMANが多いとされています(下図の%はAMANに関して)。
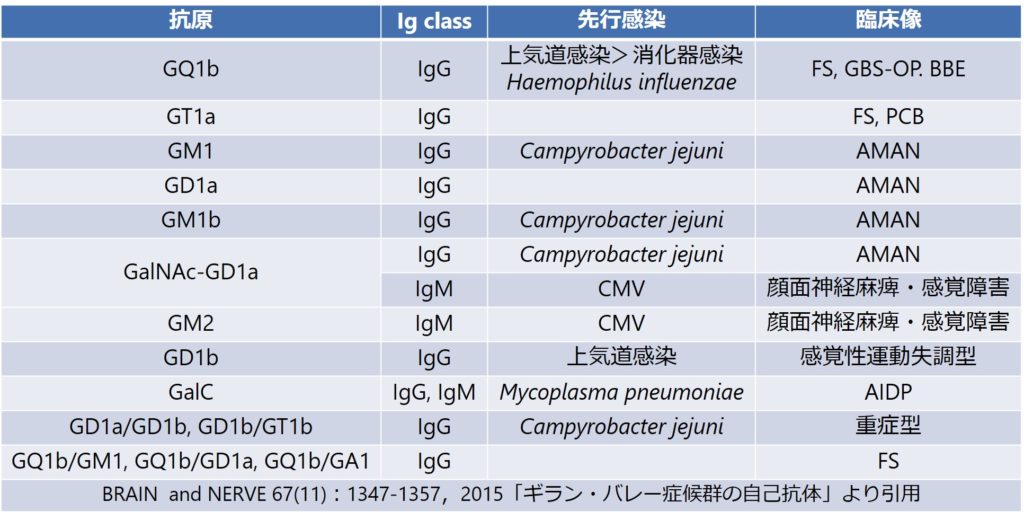
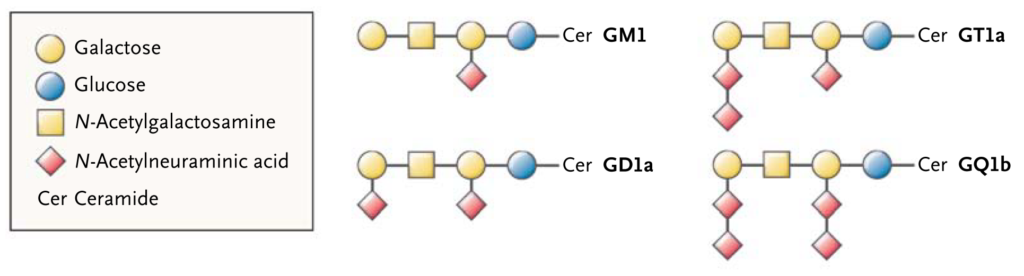
・この自己抗体として重要なのは抗ガングリオシド抗体です。抗体と病態の関係性がある程度確立しており、以下をご参照ください。
・特にアジアで多い軸索型は抗GM1-IgG, GD1a-IgG, GalNAc-GD1a-IgG抗体との関係が深いとされています。AIDPに関してはほとんど対応する抗原はまだ分かっていません(AIDPに関しては病態もAMANと比べて十分に解明されていません)。
・例えばCampyrobacter jejuni感染後にみながギランバレー症候群になる訳ではありません。おおまかに「病気になるかどうか?」は患者側の因子が関与しており、ギランバレー症候群を発症してしまった場合に「どの病型をとるか?」は菌体側の因子で決まります。
病型
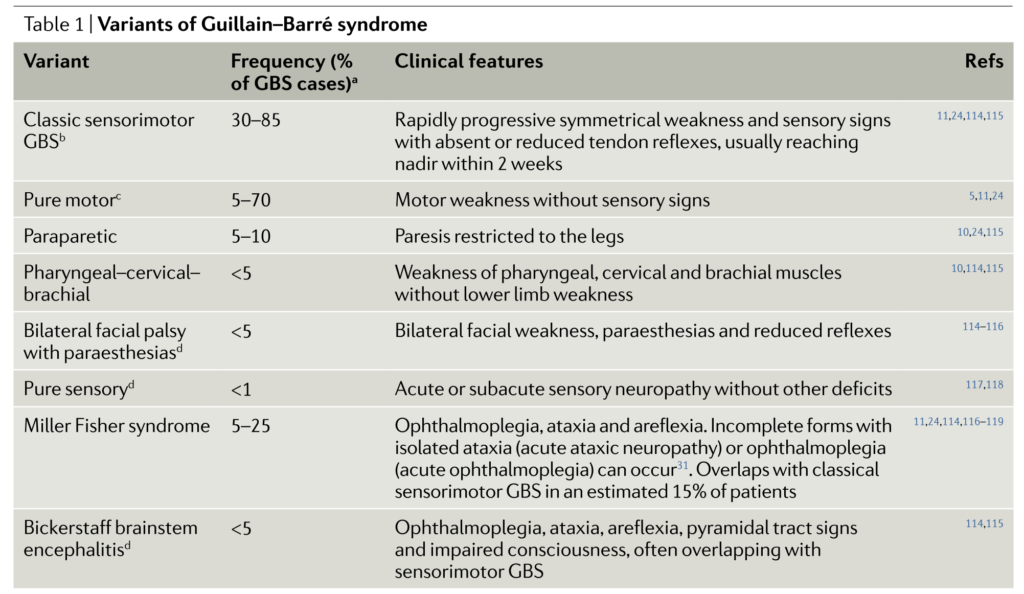
・ギラン・バレー症候群は非常に多彩な臨床病型を取ることが知られており、まとめたのが以下の通りになります。
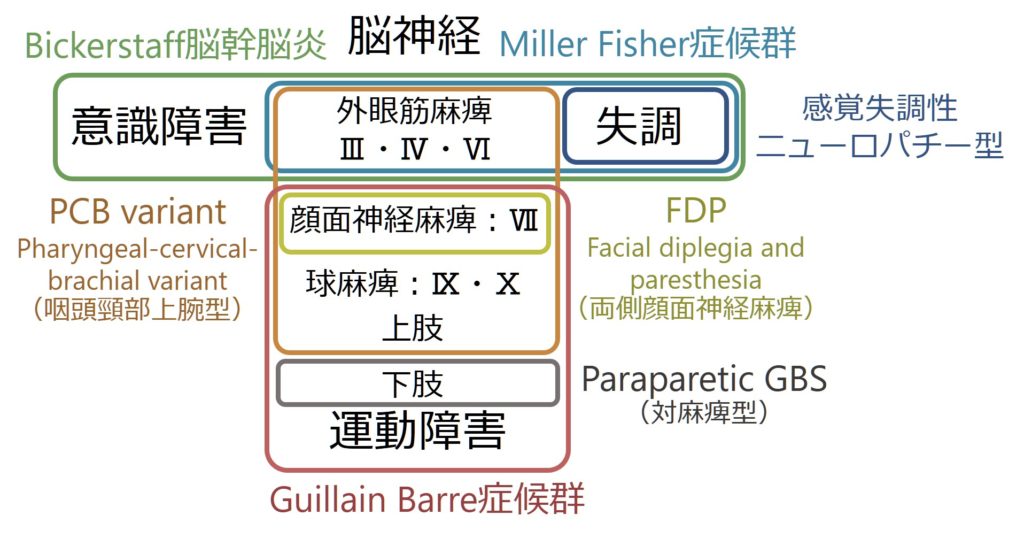
・Miller Fisher症候群に関してはこちらをご参照ください。
・FDP (facial diplegia and paresthesia)に関してはこちらをご参照ください。
・PCB variant (pharyngeal-cervical-brachial variant)に関してはこちらをご参照ください。
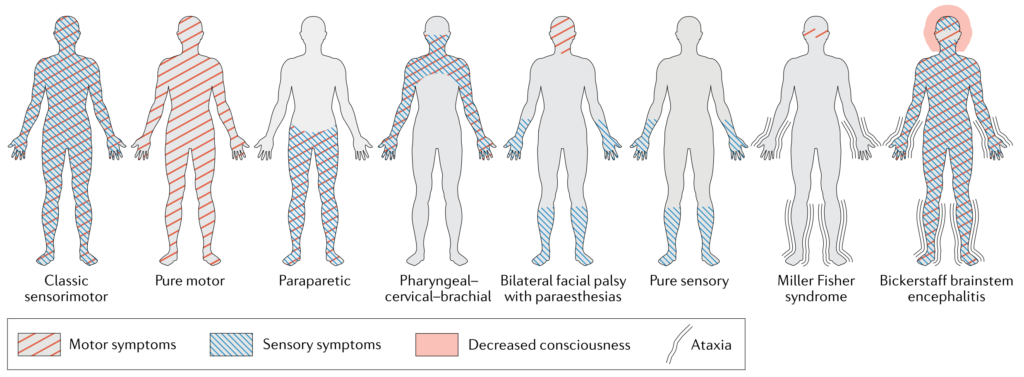
以下は各病型の頻度ですがこれは報告・国によりまちまちであくまで参考です。この記事では典型的な(古典的な)ギラン・バレー症候群の臨床像に関して解説します。
臨床像
■発症様式
・免疫学的機序を反映して急性発症であり通常「発症日」を特定できることが多い(突然発症ではない)です。通常は単相性の経過で通常2週間以内で症状はピークに達し、その後ゆるやかに改善していく単相性の経過をたどります。逆に発症から24時間以内に症状がピークに達する場合(脊髄梗塞などの血管障害を示唆する)や、4週間以上進行する場合はギラン・バレー症候群以外の疾患を考慮するべきです。
■運動症状の特徴
・近位筋・遠位筋がどちらも障害される(AIDPの場合):代謝性の末梢神経障害は長さ依存性の神経障害を呈するため遠位>近位の障害となりますが、自己免疫性のため長さ非依存性の末梢神経障害を呈します。この特徴は病歴(近位筋障害を示唆する病歴があるか?)でも神経学的所見(MMTは遠位も近位も低下しているか?)でも極めて重要です
ポイント:末梢神経障害で初期から近位・遠位筋どちらも障害する疾患は”AIDP” or “CIDP”
・伸展様式:通常は下肢からの発症し、上行性に障害範囲が拡大することが多いです(もちろん上肢からの発症や球麻痺発症などもあります)。
・左右対称性:発症当初は多少の左右非対称の場合もありますが、最終的にはある程度左右対称性に障害されることが多いです。経過中ずっと左右非対称が目立つ場合は診断に注意が必要です。
・深部腱反射低下・消失:これに関しては深部腱反射が正常もしくは亢進している例に関しても報告があり、深部腱反射低下がないだけで本疾患を否定してはいけないとされています。機序としては脊髄レベルでの抑制介在性ニューロンの機能障害が推定されています。臨床的にはたとえ深部腱反射が亢進していたとしてもBabinski徴候を伴わない点が重要とされています。
■GBSの深部腱反射亢進例systematic review J Neurol Neurosurg Psychiatry 2020;91:278–284.
・既報をすべてまとめると45例の報告(うち73.3%は日本からの報告)
・先行感染:下痢56%>上気道炎22.2%>なし20.0%
・病型:AMAN56%>AIDP4.4%
・抗ガングリオシド抗体陽性:89.7%
・足クローヌスもしくはBabinski徴候:6.7% *spasticity報告なし
・MRI実施例はいずれも脊髄に異常所見なし
・経過:53.3%はピーク時も歩行可能(人工呼吸管理が必要となった症例なし)
*ここでは深部腱反射亢進例であってもGBSを否定してはいけいないとしています。また具体例のビデオを掲載しています(元論文はこちらをご参照ください)。
■脳神経障害
・顔面神経麻痺が最も多いです。一般的なギラン・バレー症候群の経過では四肢の筋力低下に遅れて顔面神経麻痺が出現する場合が多いです(両側顔面神経麻痺から発症するFDPもあります)。
・舌咽・迷走神経障害による嚥下障害をきたす場合も多くあります(嚥下障害が主体となるPCB variantもあります)。
■呼吸筋麻痺
・呼吸筋障害は約20%程度に認めるとされます。「神経筋疾患による呼吸不全」に関してこちらにまとめがあり、診察方法なども記載があるのでご参照ください。
■感覚障害
・感覚障害が全くない場合は:神経筋接合部疾患・筋疾患(特に周期性四肢麻痺・低K血症)なども鑑別として考慮する必要があります。
■自律神経障害
・循環動態(血圧の乱高下・不整脈 最も多いのは洞性頻脈)、排尿障害、便秘、発汗障害などの自律神経障害をギラン・バレー症候群は高率に合併します(詳しくは合併症に関してこちら)。
・ただ膀胱直腸障害が臨床像の主体になる場合は脊髄疾患の可能性に注意が必要です(ギラン・バレー症候群よりも)。
■疼痛
・神経根部での炎症を反映した強い背部痛・下肢への放散痛、その他筋痛・神経性疼痛を認める場合が多くあります。
・55人のギラン・バレー症候群患者の疼痛に関して調べた研究では、受診時に85.5%、経過中に89.1%の患者が疼痛を訴え、16人では疼痛が筋力低下に6.1日先行し、受診時のVASは4.7±3.3、疼痛のタイプとしては腰痛・下肢痛61.8%、四肢の異常感覚49.1%、四肢筋痛34.5%、内臓痛20%であったと報告されています(NEUROLOGY 1997;48:328-331)。
・神経根部での炎症を反映してSLR(straight leg raising test)が陽性となる場合もあり確認したいです。ギラン・バレー症候群での疼痛への治療に関してはこちらをご参照ください。
*AMANとAIDPでの臨床像の違いに関しては下図を参照ください(Lancet Neurol 2013; 12: 1180–88より引用)。

■ギランバレー症候群に合併するSIADHに関しての報告 Neurology ® 2011;76:701–704
・50例(男性36例、女性14例)のギランバレー症候群のうち48%(24例)にSIADH合併(GBSの症状発症から8.8日後)、26例は非合併
・SIADH24例の内訳:性別男性15例、女性9例 病型AMAN9例、AMSAN8例、AIDP7例
*人工呼吸器13例(内12例は人工呼吸器開始前からSIADHを認めている)
*ほとんどが無症状であったが、2例は痙攣また見当識障害を認めた(補正を要した期間は中央値4.2日)
・重症度:mild Na=130-135mEq/L: 6例、 moderate Na<130 mEq/L: 12例、 severe Na<125mEq/L: 6例
・SIADHと相関関係のある因子:年齢(>50歳)・重症度・球麻痺・在院日数・呼吸器管理など
*病型、男女、先行感染は相関関係なし
*考察:機序は解明されていない(陽圧換気前から認めており人工呼吸器関連ではなく純粋に現病と関係しているだろう)
*IVIg投与による高たんぱく血漿での偽性低Na血症の報告もあり、IVIg投与の低Na血症では必ず血漿浸透圧を確認して真の低Na血症かどうか確認することに注意が必要(”Intravenous Immune Globulin and Pseudohyponatremia” N Engl J Med 1998;339:632. Mayo clinicからギランバレー症候群患者にIVIg投与しNa値が143→127→122mEq/Lへと低下した症例報告)
検査
・採血検査:電解質、免疫グロブリン(IgG, IgA)、CK、凝固機能、甲状腺機能(TSH)、ビタミンB1,B12
*治療開始前の血清検体は貴重なので、かならず多く血清保存を採取しておく
*血管炎の可能性を考慮する場合は各種抗体、尿沈渣なども追加
・感染:EBV、CMV、Mycoplasma pneumoniaeの抗体検査
・抗ガングリオシド抗体(血清 *髄液ではなし) *抗GM1, GQ1b抗体の2つは保険適応(抗ガングリオシド抗体は杏林大学さん、近畿大学さんなどで検査を受け付けてくださっています)
・心電図検査
・呼吸機能検査(実施が難しい場合は血液ガス検査)
・便培養検査:Campyrobacter jejuniの検出
・髄液検査:蛋白細胞解離
・電気生理検査・神経伝導検査
髄液
・蛋白細胞解離:神経根部でのBNB(blood nerve barrier)破綻を反映して、髄液中の蛋白が上昇します(QAlb上昇)。発症直後には蛋白細胞解離は認めない点に注意が必要なことと(発症1週間では蛋白上昇30-50%であり、経過とともに顕在化してくる)、蛋白細胞解離は非常に非特異的な所見(頸椎症でも生じる)なためこれだけをもってGBSを診断する力はなく、あくまで参考所見である点に注意が必要です。髄液検査の目的はGBSを診断するためというよりも、その他の疾患を除外するために行います。
・髄液細胞数が上昇する場合は炎症性疾患:神経サルコイドーシス(特に多発神経根症を呈するもの)や感染、腫瘍などをGBS以外の疾患を考慮する必要があります(この点に関してはこちらをご参照ください)。
参考文献:GBSの髄液所見(IGOS 1500例のGBSの髄液所見の解析) Neurology ® 2023;100:e2386-e2397.
・蛋白上昇:70% 中央値 67 mg/dL, 発症からLPまでの中央値期間 4日
・発症からLPまでの期間 ≦4日 57%,>4日 84%
*0-1日 48%, 2-3日 55%, 4-5日 76%, 6-7日 84%, 8-14日 87%, >14日 85%
→髄液蛋白上昇はどの時期にLPを行うか?により変化する点に注意(発症直後は蛋白正常の場合もある)
・蛋白が高い値の場合:脱髄(中央値 80 mg/dL),近位と全体の筋力低下,短期の機能予後悪いことと相関関係あり
・Miller Fisher症候群は蛋白正常が多い:中央値 45 mg/dL
・細胞数:<5/μL 83%, 5-49/μL 16%, ≧50/μL 1%
・蛋白細胞解離:細胞数<50の定義(Brighton criteria) 70%, ≦10の定義(Asbury and Cornblath) 64%
造影MRI検査
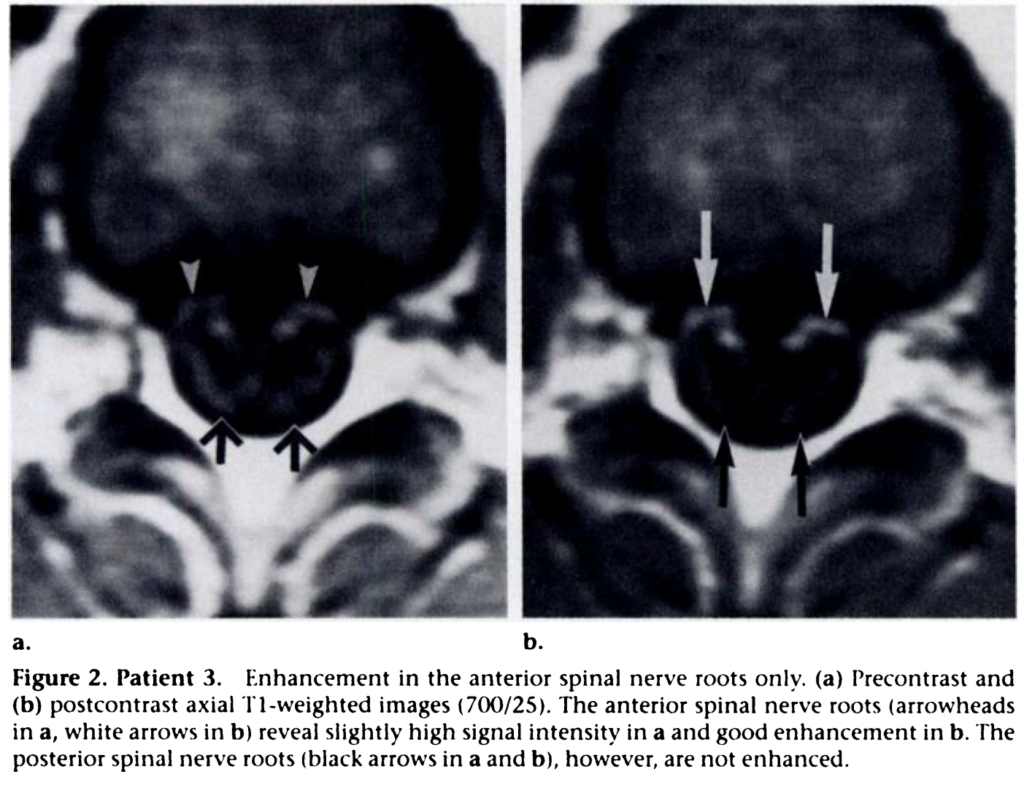
・ギラン・バレー症候群では神経根の腫大や増強効果を認めることが特徴です(前根>後根の場合も報告されている)。しかし、これはギラン・バレー症候群以外でも神経根の腫大や増強効果を認めるためギラン・バレー症候群に特異的な所見ではありません。造影MRI検査での神経根腫大・増強効果に関してはこちらをご参照ください。
神経伝導検査
・ギラン・バレー症候群ではBNBが生理的な脆弱な神経根部・最遠位部・圧迫部位(common compression site)が障害されやすいです。これはつまり、障害が神経の長さに依存しない(non-length dependent)ということを意味しており、長さが短い神経(近位筋を支配)、長さが長い神経(遠位筋を支配)どちらも障害されることを意味しています(これはCIDPのチャプターでも解説させていただいており、こちらをご参照ください)。
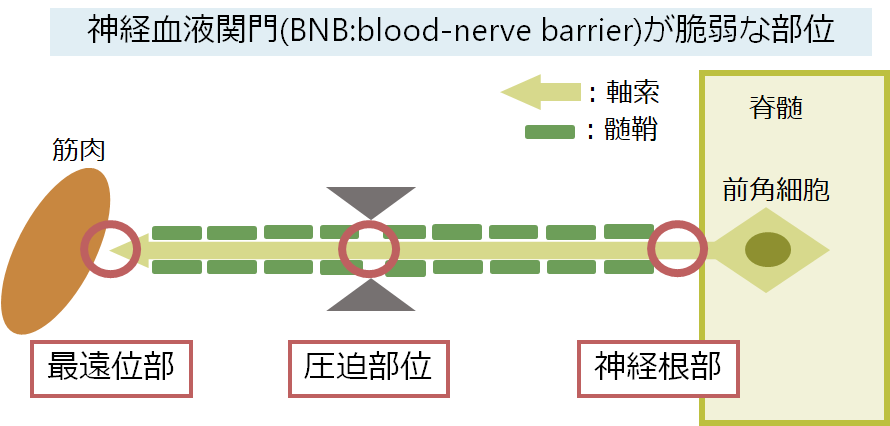
・このことを反映して腓腹神経のSNAPだけ障害を免れる“Sural sparing pattern”(AMNS: abnormal median normal sural)が特徴的な所見です(SuralのNCSを実施する場合は神経の途中の部位であるため最遠位部ではなく、圧迫部位でもないため)。これはCIDPとAIDPで認める重要な所見です。
*参考文献:Eur Neurol. 2004;51(4):196-8.(AIDP26例でのSNAP異常所見は正中神経85%、腓腹神経38%:千葉大学桑原先生のご報告)
・発症直後は神経根部の障害が主体だと遠位までWaller変性が及んでおらず、CMAP、SNAP共に保たれ異常所見はF波のみの場合”isolated abscence of F-wave”があります。このため、特に発症直後の初回神経伝導検査のみではギラン・バレー症候群の否定は困難であり、神経伝導検査を時間をあけて繰り返すことが診断(特に病型診断)に重要です。
*参考文献:J Neurol Neurosurg Psychiatry 2000;68:191–195(62例のGBS患者のうち19%(12例)で”isolated abscence of F-wave”を呈した報告:千葉大学桑原先生のご報告) 他の報告では27%(Arch Neurol 1990;47:881–7.)、10%(Electroencephalogr Clin Neurophysiol 1994;93:255–64.)と報告。
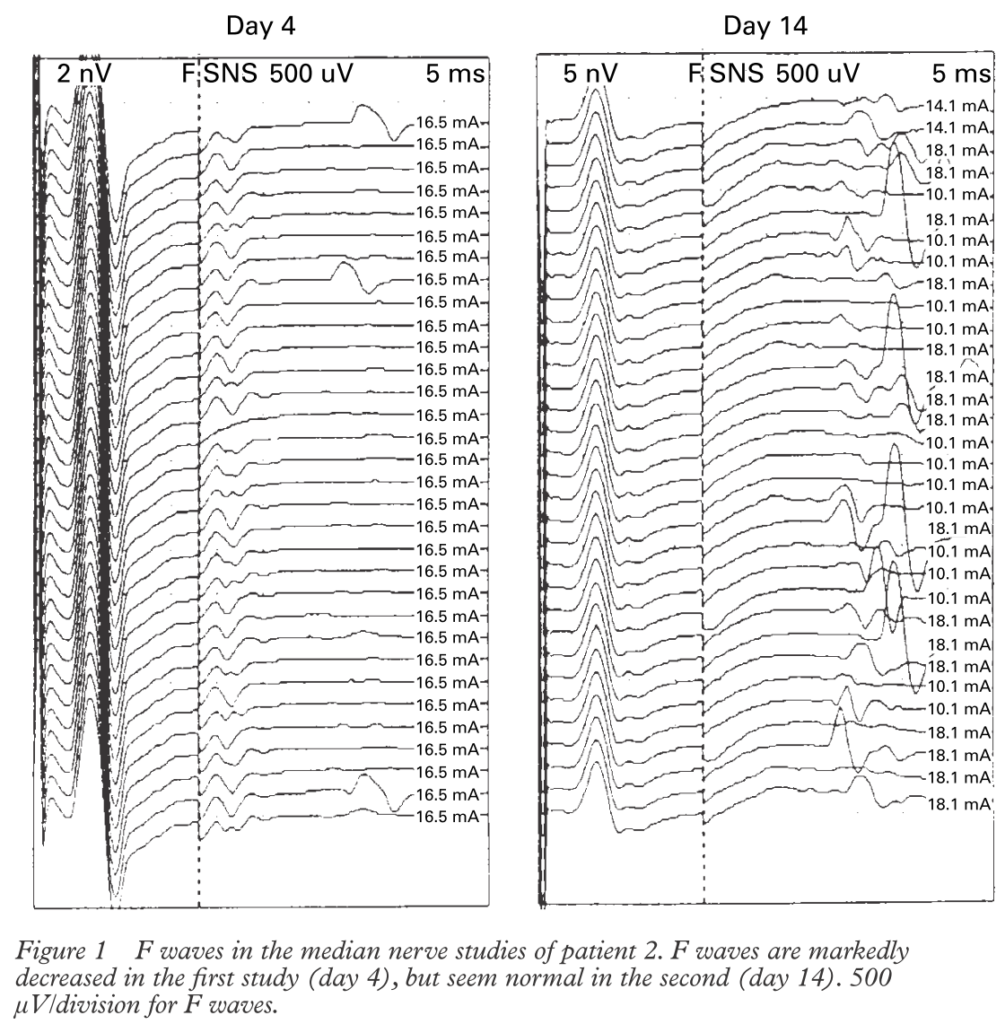
→これら検査の解説から分かるように「発症直後のギラン・バレー症候群は各種検査が陰性であってもいずれも否定はできず、臨床像から疑う」しかありません。発症直後は臨床診断でギラン・バレー症候群と判断し、治療に踏み切りますが、発症早期では必ずギラン・バレー症候群mimickerを念頭に置く必要があります。
このようにギラン・バレー症候群は単一の指標・検査で診断できる疾患ではなく、病歴聴取・神経学的所見・検査の解釈の総合力が問われる難しい疾患です。私は神経内科を専門とするまでギラン・バレー症候群がこんなに診断が難しい疾患だとは理解できていませんでした。経験を積むにつれてギラン・バレー症候群の奥深さを痛感しています。
鑑別診断
責任病巣部位別の鑑別疾患を挙げます。
・延髄:両側延髄内側梗塞(こちらを参照)
・脊髄:AFM(acute flaccid myelitis: polio, enterovirusD68/A71, 日本脳炎ウイルス)、脊髄炎、脊髄梗塞(こちらを参照)など
・神経根:多発神経根症(polyradiuclopathy)を呈する疾患が鑑別(下図)こちら参照
・末梢神経:血管炎(こちらを参照)、ポルフィリン症、ビタミンB1,B12欠乏、中毒(アルコール、鉛、タリウム、ヒ素、有機リン、エチレングリコール、メタノール、ヘキサン)
・神経筋接合部:重症筋無力症、LEMS(こちらを参照)、ボツリヌス中毒
・筋疾患:周期性四肢麻痺、低K血症、炎症性筋疾患など

合併症
ギラン・バレー症候群に伴う合併症としては以下のものが挙げられます。これら合併症に関してはこちらのまとめをご参照ください。
・呼吸不全(人工呼吸管理)
・深部静脈血栓症
・自律神経障害:血圧変動・不整脈・尿閉・便秘
・低Na血症(SIADH)
・疼痛
・廃用による拘縮、褥瘡
これまで健常であった人に急激に日常生活での制限が生じるため、特に若い方の場合気分ががくっと落ち込んでしまうも多くあり、精神的なサポートも重要です。
予後予測
ギラン・バレー症候群の予後予測に関してはこちらにまとめがありますのでご参照ください。
治療
治療に関してはこちらをご参照ください。
以上ギラン・バレー症候群に関してまとめました。ギラン・バレー症候群は「簡単に診断できるもしくは除外できる疾患」では全くありませんし、「抗ガングリオシド抗体を測定すれば診断できる疾患」でも全くありません。臨床像が幅広く、病歴・神経学的所見・検査を総合的にきちんと解釈して初めて診断できる疾患で私もまだまだ勉強不足な点が多いです。今回の記事が少しでも日常臨床の参考になりましたら幸いです。
参考文献
・Nat Rev Neurol. 2019 Nov;15(11):671-683. ギラン・バレー症候群の臨床に関して非常に詳しく、分かりやすくまとめたreviewです。
・N Engl J Med 2012;366:2294-304. NEJMのreviewであちこちの文献でよく引用されています。
・Lancet Neurol 2008; 7: 939–50 こちらもreview
・Lancet Neurol 2013; 12: 1180–88 桑原先生の書かれたreview
・Brain and Nerve「特集 ギラン・バレー症候群」
管理人記載 更新
2021/6/12 特にhyperreflexiaに関して
2021/11/3 SIADHに関して追記
2023/7/19 GBS髄液所見の臨床試験結果について記載 Neurology ® 2023;100:e2386-e2397.