結局は病理診断でないと答えが分からない(つまり独りよがりな診断になってしまう)ため苦手意識を持つ方も多いと思いますが、個人的には去年「往診」をするようになってから、かなり興味を持つようになりました。診察室の中での出来事よりも「日常生活」へどれだけイメージを膨らませることができるか?という視点が認知症診療へ興味を持つきっかけになったように感じています。2010年時点で65歳以上の認知症有病率は15%と推定されており、primary careにおいてもとても重要なテーマです。まだまだ不十分かつ勉強不足なので今後少しずつまとめていきたいと思います。
臨床像
early-onset ADに関してはこちらにまとめておりますのでご参照ください。ここでは典型的なlate-onset ADに関してのまとめを掲載させていただきます。
中核症状
記憶障害:前向性健忘が主体となり初期の臨床像を呈します。記憶障害に関してはこちらもご参照ください。
・ここもMMSEで「さくら・ねこ・電車」の再生が不良になることが特徴的です。
*鑑別のポイント
・正常老化:十分な病識を有する
・うつ病:物忘れを過大に訴える
・アルツハイマー型認知症:病識に乏しい 「なぜ医療機関を受診したが?」の動機を確認することが重要。家族に指摘されて受診したか
・取り繕い反応、”head turning sign”
見当識障害:時間→場所→人の順に障害されることが多い
・この点はMMSEで評価すると分かりやすいですが、病院の名前は言えるけれど「今日が何月何日か言えない」、「診察室あるカレンダーをこっそりカンニングしようとする動作」などが特徴的です。
・初診時にMMSEで評価することが多いと思いますが、この前向性健忘+時間の見当識障害のところだけ失点するのが初期のアルツハイマー型認知症では臨床的な特徴と思います。
・その後は遂行機能障害、視空間認知障害、失行などの皮質症状が出現してきて広がりをみせていきます。
・運動障害や錐体外路症状、ミオクローヌスなどは通常初期から認めることはなく、これらを認める場合は他疾患を考慮します。
・early-onset ADでは逆にこの視空間認知障害や失語などが先行する点がlate-onset ADとの臨床的な違いです。もちろんearly-onsetでなくともこのような非典型的な経過をとるlate-onset ADもあります。
診断基準:National Institute on Aging-Alzheimer’s Association work-group(NIA-AA)
probable AD:認知症があり
A:数か月から年単位で緩徐進行性
B:認知機能低下の客観的病歴
C:以下の1つ以上が病歴と検査で明らか
・健忘症状
・非健忘症状:失語・視空間機能障害・遂行機能障害
経過
・MMSEは文献上は平均3.3点/年で減少していく経過(過去の報告ではこのように報告されており予後は10年程度とされているが、現在はより緩やかでまた個人間の違いも大きい)
・病理学的にも初期の段階は正常老化とスペクトラムになっているため、初期の段階で確定診断をすることは困難。
*FAST(fuctional assessment staging):重症度分類
・Stage 1,2,3:正常老化
・Stage 4,5,6,7:アルツハイマー型認知症 *Stage4になると必ず徐々に進行する
合併
てんかん:特に重要なテーマでこちらのまとめをご参照ください。
CAA:こちらをご参照ください。
検査
遺伝子検査
APOE遺伝子ε4:遺伝的危険因子(原因遺伝子ではなし*重要)
・現時点ではルーチンでの検査は推奨されていない
・診断においても特異的ではないとされている
髄液検査
・Aβ42低下:脳Aβ沈着量と相関関係にある 感度81-96%, 特異度77-89%
・タウ(リン酸化タウ)増加:神経原性変化・神経細胞死を反映
*管理人は若年性で悩む場合などに実施を検討しています。
頭部MRI検査
・側頭葉内側の萎縮:嗅内野において選択的に脳萎縮が出現→海馬支脚→CA1へと進展
・late-onset AD:側頭葉内側の選択的萎縮/early-onset AD:後部帯状回・頭頂連合野の萎縮が目立つ
*若年性ADは画像所見もlate-onsetと異なる点に注意
・視覚的判断に頼らないVSRAD®などの体積測定の自動解析方法が出てきています
・個人的には「画像検査で側頭葉萎縮=アルツハイマー型認知症」という図式が危険と思っています。やはり総合的に判断するべきです。
*AGDでは側頭葉内側の萎縮で左右差が目立つ点が特徴です。しかし、アルツハイマー病でも左右非対称になる場合があり、「左右差=AGD」という図式も危険です。
脳血流SPECT
血流低下を認める部位
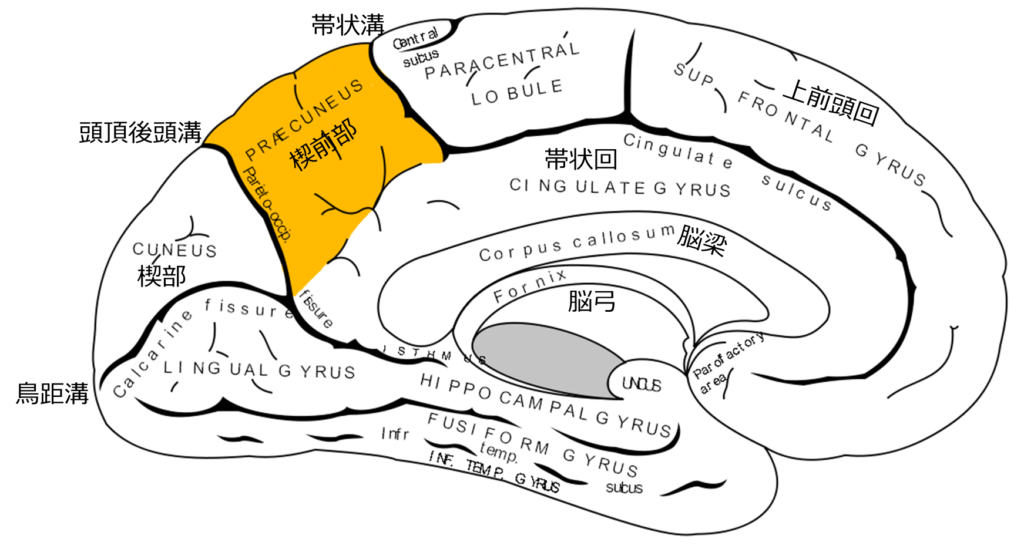
1:後部帯状回・楔前部(頭頂葉内側面):嗅内野(初期に萎縮を呈する)と連絡するため遠隔的な血流低下?
2:頭頂連合野(特に下頭頂小葉)→進行すると→側頭連合野→前頭連合野
*DLBでは上記部位に加えて後頭葉の血流低下も認める点が鑑別点
*萎縮を呈する海馬は血流低下を呈さない場合が多い
*小脳・線条体・視床・後頭葉・1次感覚運動野の血流は相対的に保たれる→同部位の血流低下が進行すると相対的に後部帯状回などの血流低下所見が目立たなくなる点に注意
*CBDでは線条体・視床・1次感覚運動野に血流低下を認める点が異なる
*楔前部は解剖的に分かりにくいと思うので下図にwikipediaのpublic domainとなっている図(大脳内側面)を掲載させていただきます。
アミロイドPET検査
■トレーサー:11 C-PiB(チオフラビン誘導体・脂溶性高い・BBB透過性) *11C半減期20分
→18F-標識薬剤(florbetapir, flutemetamol)
■判定:視覚評価によりアミロイド沈着「陽性」または「陰性」の判定を下す *定量に関してはまだ未確立
・陰性:白質および視床に非特異的集積がみられるのみ (解釈)ADの可能性は極めて低い
・陽性:皮質に集積を認める (解釈)他の認知症や正常加齢でもアミロイド沈着は認めるため総合的判断が必要(アミロイドPET陽性=ADの診断とはならない点に注意)
*特に若年性を疑う場合は有用になる可能性がある
病理
・老人斑、神経原線維変化はいずれもアルツハイマー型認知症に特徴的な所見ですが、疾患特異的ではなく(正常者でも認める)ある閾値を超えると症状を呈します。このように正常と病気の間にスペクトラムがある点が特徴です。
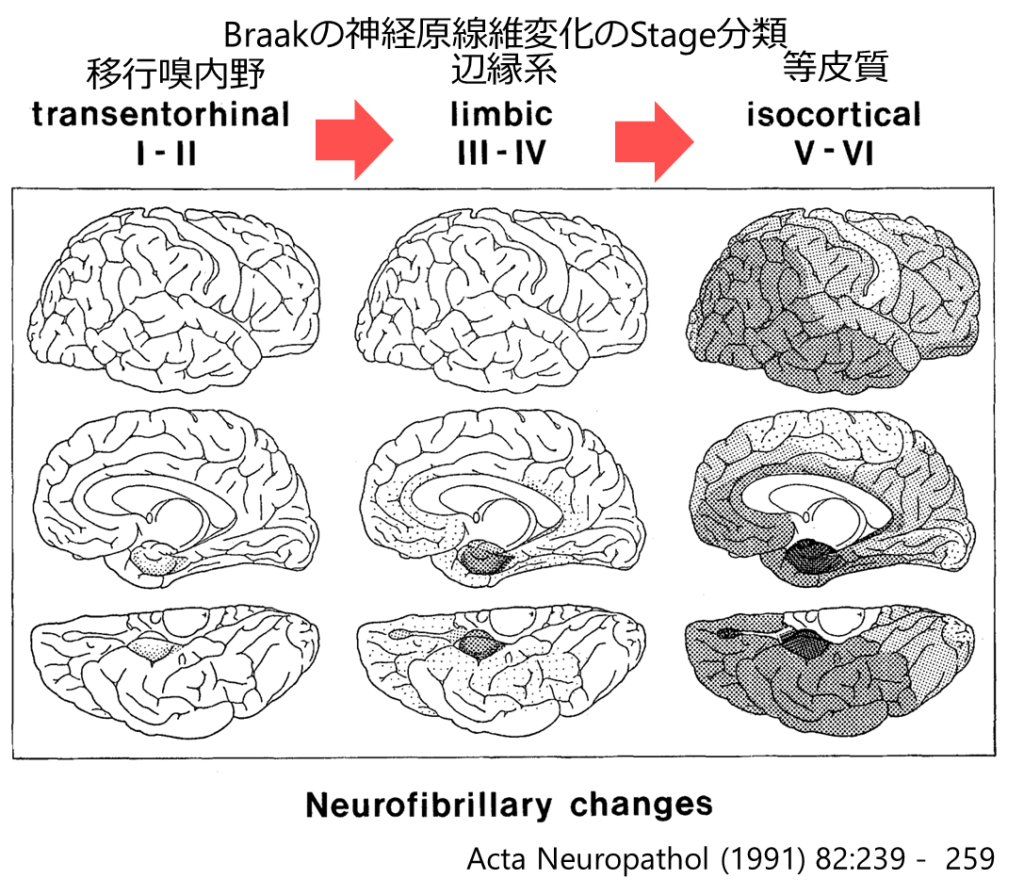
■神経原線維変化(NFT: neurofibrillary tangle)のステージ分類:Braak
StageⅠ~Ⅱ:Transentorhinal stage 移行嗅内野(同部位から出現)
StageⅢ~Ⅳ:Limbic stage 辺縁系(嗅内野)
StageⅤ~Ⅵ:Isocortical stage 皮質
*構成成分はタウ蛋白
■老人斑(Neuritic plaque)のステージ分類:CERAD
*構成成分はアミロイドβ蛋白(Aβ)
■アミロイドβ伸展に関するステージ分類:Thal
上記を合わせた病理診断基準:NIA-AA(National Institute on Aging-Alzheimer’s Association workup)
*上記Thal, CERAD, Braak分類の点数化により4段階評価(なし、程度、中等度、高度)で評価する
薬剤治療に関して
多くの誤解がうずまいているのが認知症の治療薬に関してです。個人的に考える原則を整理したいと思います。
1:認知症治療薬(抗認知症薬)は認知症を治療する訳ではない
・認知症治療薬(または抗認知症薬)というのはそもそも名前が良くないと個人的には思います。そもそもアルツハイマー型認知症を治療できる薬剤ではないという点をまずご本人、家族にこの点をきちんと説明することが重要です。時々医療従事者でも勘違いしている方がいるためちゅいが必要です。
・そもそも薬剤効果としてコリンエステラーゼ阻害薬はアセチルコリンを増やす作用を持ちます。それだけで神経保護的に働くわけではありません。またもともとこれらの薬剤は現在主流のAβ仮説に則って開発された薬剤ではないため、根本的な病態にはアプローチできていないというそもそもの議論があります。
・この点を患者さん、ご家族にも事前にきちんと説明しておかないと「あの先生は認知症治療の薬を処方してくれない悪い先生だ!」ということになってしまいその後の信頼関係や治療継続に支障が生じることになってしまいます。
2:基本はアルツハイマー型認知症に対して使用する
・認知症に対して認知症治療薬を使用するのではなく、「アルツハイマー型認知症」に限定して(一部レビー小体型認知症も保険適応になっていますが)使用します(もしも処方する場合は)。
・これもなんとなく認知症にたいしてポンと処方されてしまっている場合が多々あるため注意したいところです。
3:目的は何かを明確にする
・「なぜ薬剤を使用するか?」の目的を明確にする必要があります。
・多くの臨床試験はプラセボとのRCTで評価尺度をADAS-cogという指標が用いられています。重要なのはこのADAS-cogの点数で有意差が出たという統計学的な意味と臨床的に患者さんにメリットがあるという間には大きな隔たりがあるという点です。
・コリンエステラーゼ阻害薬はアセチルコリンを増加させるため、徐脈や下痢などの副作用を生じます。コリンエステラーゼ阻害薬の中毒に関しては中毒のトキシドロームの記事でまとめているためこちらをご参照ください。
・高齢者では潜在的に房室ブロックなどを有している場合もあるため、もし処方する場合は必ず事前に12誘導心電図を確認する必要があります。
・ご存じの方も多いと思いますが(まだ色々ご意見もあるかもしれませんが)フランスでは2018年に保険適用から外されています。このように非常に効果と副作用の天秤にかけることが重要な薬剤です。
4:処方するのであればきちんと効果判定を行う
・どんな薬でもそうですが、「どうなったら効果なしと判断して使用を中断する必要があるか?」を処方する前に事前に決めておき処方する必要があります。臨床試験で用いられているADSA-cogでフォローすることは全く現実的ではないため、基本的にはMMSEを外来で半年~1年おきくらいにフォローすることになります。
・その点でぽんと処方して終了というのは責任がないため注意です。
*よく薬剤中断率が認知症治療薬は高いという点が取り上げられて「きちんと内服の利点を説明するべきだ」というDrがいらっしゃいますが、それはあくまでその薬剤が予防につながる場合に限定された話です。確かに降圧薬は内服していてもご利益を感じないかもしれませんが、それは長期に内服を継続することで心血管合併症を予防する効果があるため継続するべきという議論になります。しかし、コリンエステラーゼ阻害薬は別に病態を改善する訳ではない点(DMTではない)に注意が必要です。
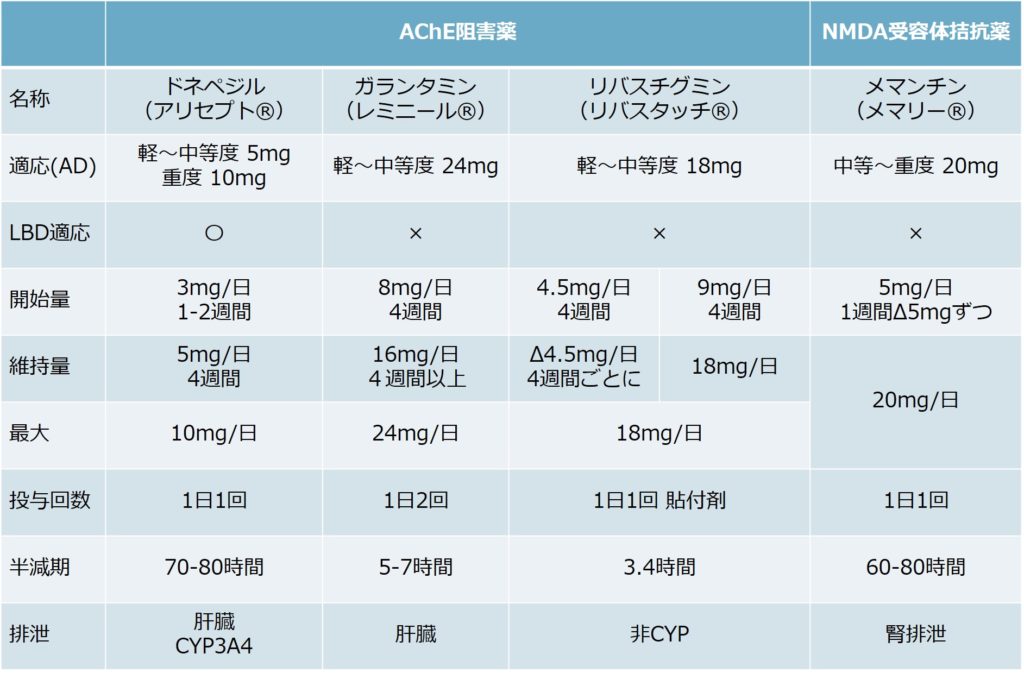
以下に薬剤の一覧を掲載します。もし使用する場合注意することは以下の点です。
・コリンエステラーゼ阻害薬の併用は禁忌(これもよく併用されて処方されているケースを目にします)。コリンエステラーゼ阻害薬とメマンチンは併用可(作用機序が違う)です。
・メマンチンは腎機能障害により調節が必要です。
非薬剤治療に関して
こちらが圧倒的に重要です。これは今後記載していきます。
参考文献
・科学的認知症診療 5Lessons 著者:小田 陽彦先生
・認知症疾患診療ガイドライン2017
・画像診断医のための認知症画像診断


