心房細動の合併症として全身への塞栓症(特に脳塞栓症)が問題となります。心房細動での抗凝固療法に関してここでまとめます。
心房細動による塞栓症のリスク評価
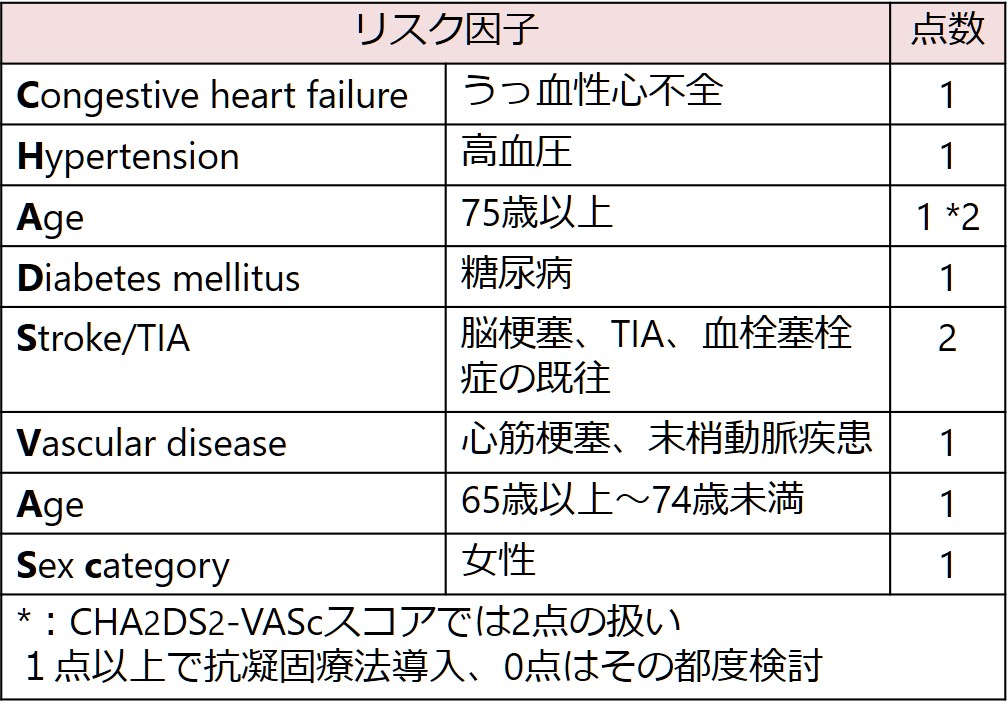
代表的なリスク評価がCHADS2 scoreとCHA2DS2-VASc scoreです(下図)。点数が高ければ高いほど塞栓症リスクが上昇します。注意としてはこれはあくまで非弁膜症性心房細動の場合の話です。人工弁患者さんや僧房弁狭窄症患者さんではこのスコアは適応にならないため注意が必要です。日本のガイドラインではCHADS2 scoreでのリスク評価が推奨されています。
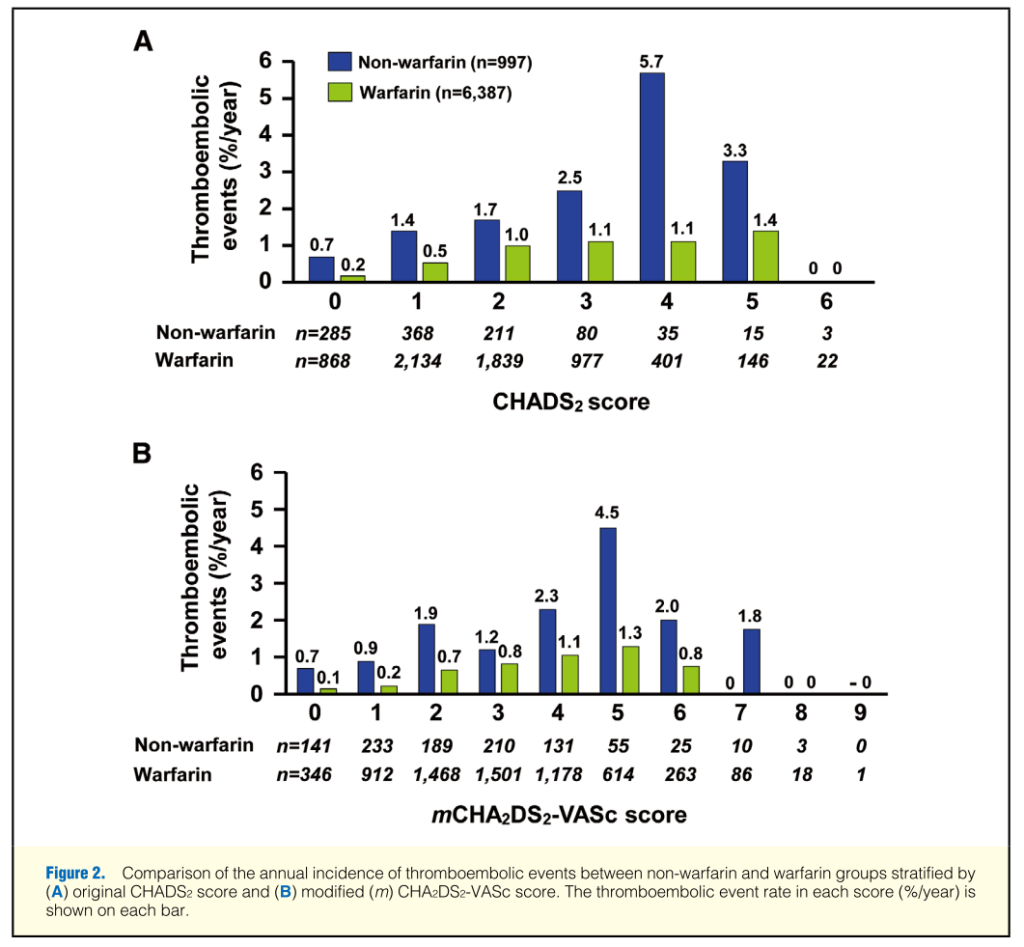
日本人でのこれらのスコアにより塞栓症のリスクがどうなるか?を調べたのが下記になります(Circ J. 2014;78(7):1593-9. J-RHYTHM Registry Investigatorsによるもの)。
心房細動の持続時間は関係あるのか?
上記のリスク評価は発作性心房細動の場合も持続性心房細動の場合も適応となります。つまり発作性心房細動で洞調律の期間があるからといって塞栓症のリスクがない訳ではありません。では具体的に何分、どのくらいの頻度で心房細動が持続すると血栓リスクとなるのか?に関して明確な根拠は現時点ではありません。
この評価が難しい点として心房細動は無症候性に起こりうる点が挙げられます。無症候性の心房細動は症候性と同様塞栓症のリスクになることは知られています(NEJM 2012;366:120)。この点を解消するためにペースメーカー留置中の患者さんや埋め込み型ループレコーダー留置中の患者さんでのデータを参考にした研究が最近あります。
多くの研究で5分以上の持続は塞栓症のリスクになりうるとされています。逆に20秒以下は塞栓症のリスクとならないという報告もあります(Circulation 2016 Oct 18; 134:1130.)。
また従来心房細動から洞調律に戻った時に心耳が収縮することで血栓が飛びやすいのではないか?という意見がありますが、最近の研究では心房細動が検出された直後に塞栓症のリスクが高く、時間と共にリスクが低下していく可能性も示唆されています(Circ Arrhythm Electrophysiol. 2015;8:1040)。
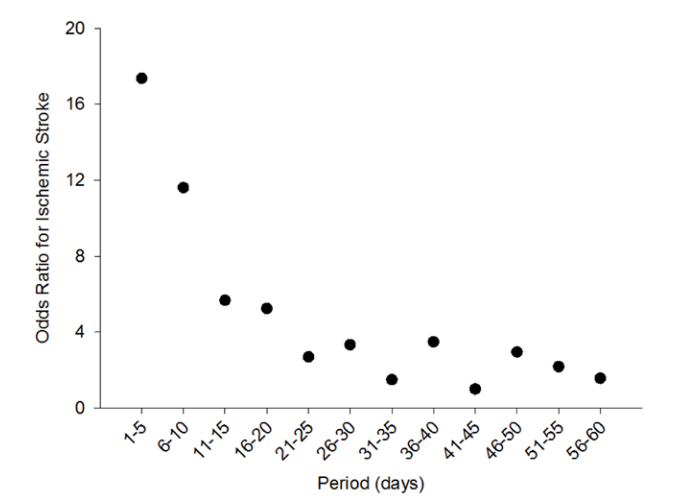
まだまだ心房細動の持続時間などに合わせて抗凝固療法の適応や種類を変えていくほどのエビデンスには乏しい現状です。
Rate control, Rhythm controlをすると塞栓症リスクは下げられるのか?
今までの臨床試験の結果から、Rate control, Rhythm controlいずれを導入しても塞栓症リスクは変わらないことが分かっています。何となく塞栓症リスクが軽減しそうなイメージがあるかもしれませんが、実際には変わりません。つまり、Rate control, Rhythm controlと塞栓症予防目的の抗凝固療法は独立して考える必要があります。
抗凝固療法
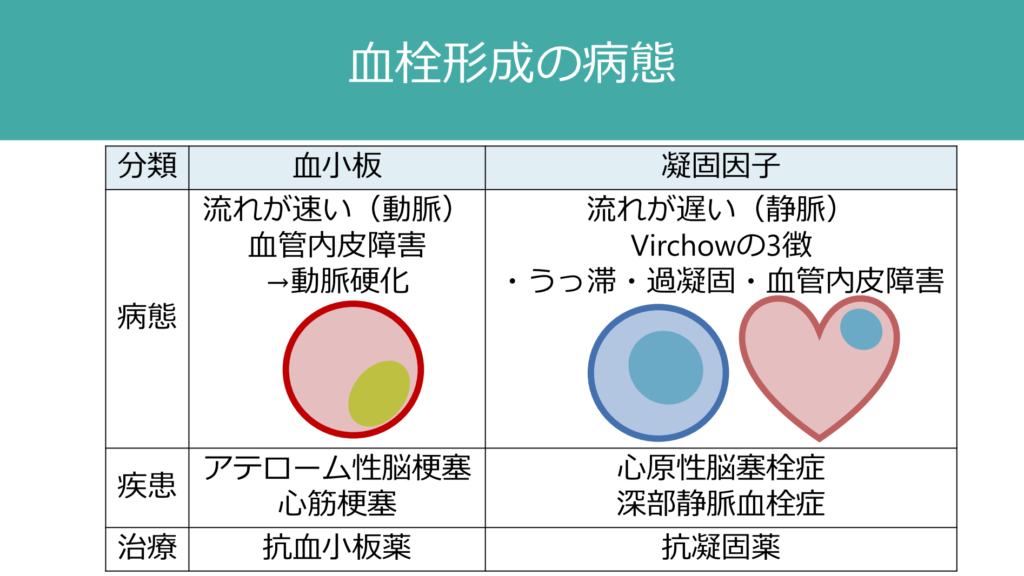
心房細動は血流が左心耳でうっ滞し、血栓が形成されそれが塞栓源となります。このようにうっ滞して生じる血栓の主病態は血小板ではなく凝固因子で、いわゆるVirchowの3徴を満たしたものになり、代表的なものとして心房細動による血栓や深部静脈血栓症が挙げられます。これらに対しては抗凝固療法が適応となります。
このあとワーファリンとDOACの話をしますが、ワーファリン、DOACいずれも抗凝固療法により血栓塞栓症のリスクを約2/3程度(約60~70%)下げることが出来ます(いわゆるrelative risk reduction)。リスク評価にあたり、私はこの数字は覚えておいた方が良いと思います(ちなみに抗血小板薬アスピリンは非心原性脳梗塞のリスクを約25%程度下げます)。これはベースラインのリスクによりません。ここまでリスクを下げる薬は世の中なかなかありません。
ワーファリンのINRと血栓塞栓症・出血合併症の関係
ワーファリン管理でのINRと血栓塞栓症、頭蓋内出血のオッズ比に関しては下図の関係があります(ATRIA studyより)。
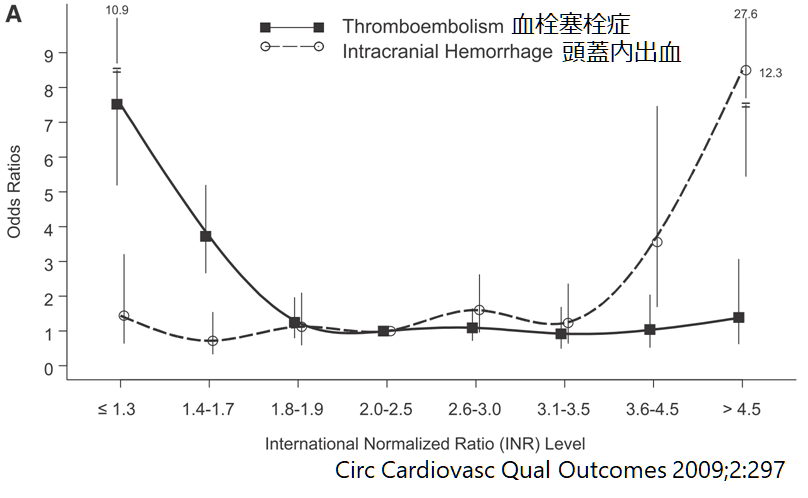
このグラフで重要なことは血栓塞栓症にしても頭蓋内出血にしてもINRと線形の関係性にはないということです。つまり一般的にイメージするようなINRの値が上がれば上がるほど血栓塞栓症のリスクが減り、頭蓋内出血のリスクが増える訳ではありません。INR1.8のあたりとINR3.1のあたりに変曲点があり、それより低いと急激に血栓塞栓症が多く、それより高いと急激に頭蓋内出血のリスクが上昇します。
つまり両者にとってのスイートスポットがあり、それが海外のガイドラインでINR=2.0~3.0を目標とする根拠になっています。ここが出血リスクと血栓リスクのバランスが最も取れている領域ということです。(日本のガイドラインでは非弁膜症性心房細動に対してINR=1.6~2.6が推奨されています)。
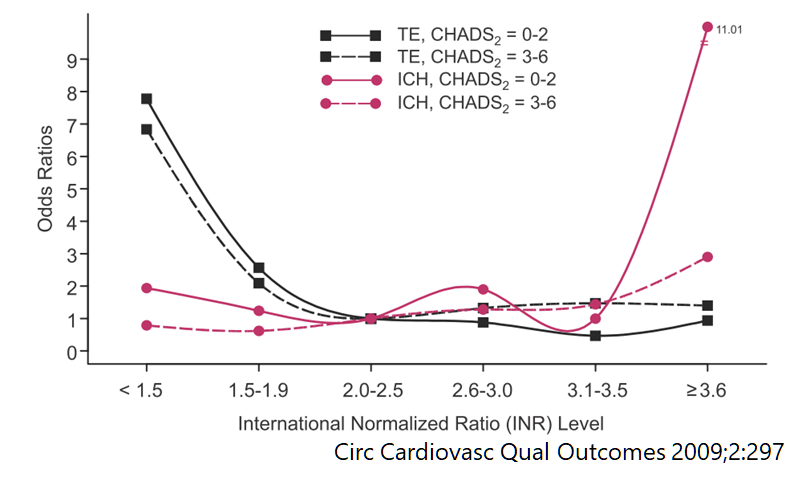
ではCHADS2 scoreが高ければ高いほどINRを高めに管理すると良いのか?という疑問が生じてきます。下のグラフを見るとCHADS2 scoreが高い群と低い群で分けて考えても同様の結果であることが分かります。つまりCHADS2 scoreが高い(つまり塞栓リスクが高い)からといってINRを高めに管理することは意味がないことが示唆されます。現行のガイドラインでもリスクに応じたINR設定の変更は推奨されていません。
ワーファリンかDOACか?
ワーファリンとDOACを比べた大規模臨床試験の結果はほとんどがDOACがワーファリンに対して非劣勢という結果です。DOACのワーファリンと異なる特徴としては、半減期が短い、拮抗薬がない(新規にでてきているが)、食事制限がない、消化管出血は多いという点が挙げられます。
DOACではなくワーファリンを選択するべき状況は、
1:人工弁置換後患者
2:腎機能障害患者(CCr<15-30 ml/min)
の2点が挙げられます。
2019年のAHA/ACCによる心房細動ガイドラインでは非弁膜症性心房細動においてDOACをワーファリンよりも推奨する記載に変わりました。2020年日本の不整脈薬物治療ガイドラインもDOACを推奨としています。このため上記の弁膜症性、人工弁置換後患者さん、腎機能障害患者さん以外はDOACを検討します。
以下に2020年の日本の不整脈薬物治療ガイドラインのまとめを載せます。
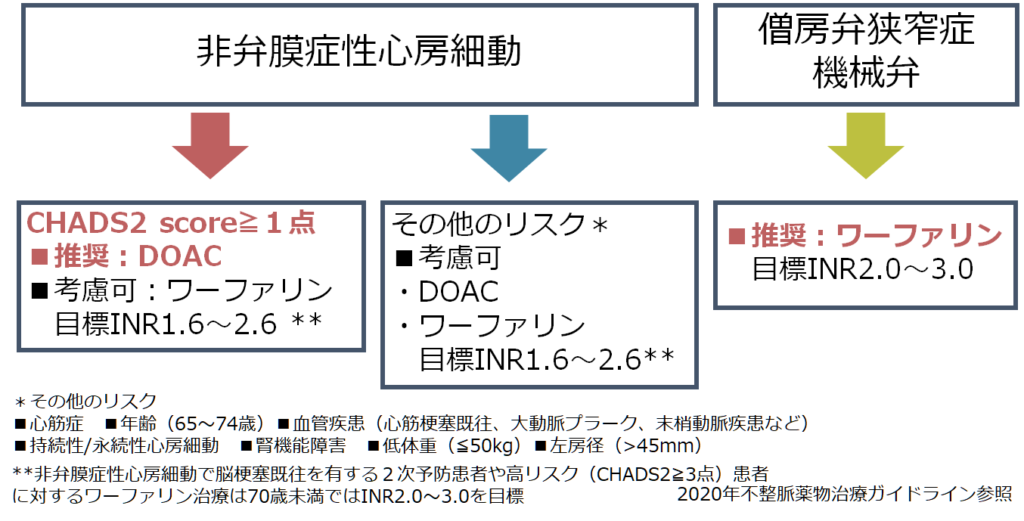
敗血症患者の心房細動に対する抗凝固療法
高齢の患者さんが敗血症で入院となると病棟やICUで心房細動になることはよく経験すると思います。この患者さんに抗凝固療法を導入することで塞栓症を予防できるのか?に関してJAMA Cardiol 2016;61:682で非経口抗凝固薬を投与された群と投与されなかった群で後ろ向きに検討すると、塞栓症はRR=0.94; 95%CI 0.77-1.15と両者で有意差はなく、出血合併症はRR=1.21; 95%CI 1.10-1.32と抗凝固薬を投与された群で有意に多い結果でした。この結果だけをもって敗血症患者の心房細動で抗凝固薬を導入しないというプラクティスにすぐなる訳ではないですが、全身状態を勘案して考慮するべきと思います。
除細動前後の抗凝固療法
48時間以上持続している心房細動の場合は、除細動前に3週間の抗凝固療法と、除細動後の4週間の抗凝固療法が推奨されています(2019 AHA/ACCガイドラインまとめ)。