神経内科は手技が少ない科ですが、筋生検と神経生検が手技として重要です。ここでは筋生検の手技に関してまとめさせていただきます(具体的な固定や染色の方法はまた別途に記事にする予定です)。施設や先生方によってやり方は多少の違いがあると思いますのであくまで参考にしていただけますと幸いです。
採取部位の選択
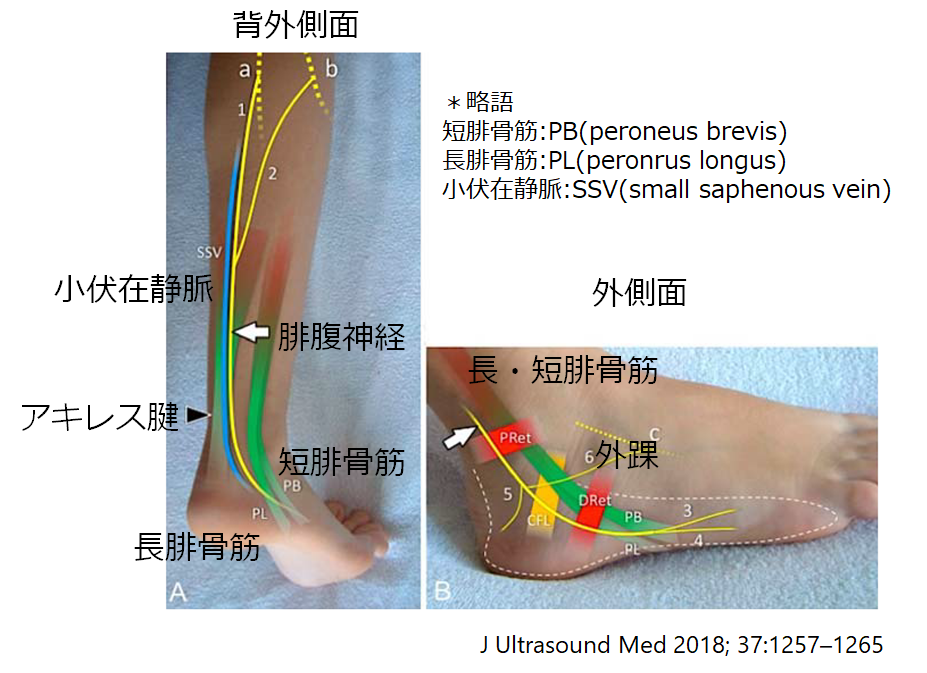
生検適した筋
・MMT4程度:筋力低下がないと所見が得られないし、筋力低下が強すぎると脂肪変性により有意な所見が得られない可能性が高いため
・MRIでの信号変化:MRIは事前に必ず行うべき
生検することが多い筋:上腕二頭筋・大腿直筋・外側広筋(基本はこれらの筋から生検する) *その他三角巾・上腕三頭筋・前脛骨筋など
*腓腹筋は生検結果の評価が難しいため通常選択しない
検体採取
0:準備で必要なもの
・ルート確保、静脈麻酔(鎮静薬、鎮痛薬、抗菌薬など適宜)
・局所麻酔:1%キシロカイン(エピネフリンなし)
・糸:4-0PDS(筋膜縫合と皮下縫合用)、絹糸(血管の結紮、筋膜に糸をかける用)、3-0ナイロン(表皮縫合用)
・道具:メス、モスキートペアン沢山、曲がりペアン、ペアン、持針器、針、剪刀(曲がり+眼科剪刀)、小筋鉤2つ、あればベッセルループ
・検体運ぶ用:濡れガーゼ(生理食塩水にひたし、固くしぼる)+シャーレ
1:皮下に局所麻酔
局所麻酔をかけるのは皮下のみで、筋膜、筋肉には麻酔はかけない。局所麻酔にはエピネフリンなしの1%キシロカインを使用する。
2:表皮切開
メスで筋繊維に対して並行方向へ皮膚を2-3cm程度切開する。
3:結合組織の剥離
筋膜が見えるまでペアンで鈍的に結合組織を剥離していく。
4:筋膜切開
筋膜が見えたら、切開を加える上下の筋膜に糸をかける、もしくは筋膜に小切開を入れたところでペアンで把持しておく。これは筋膜を切開すると筋膜の端がどこかに行ってしまい後で筋膜縫合が出来なくなってしまうことがあるため。
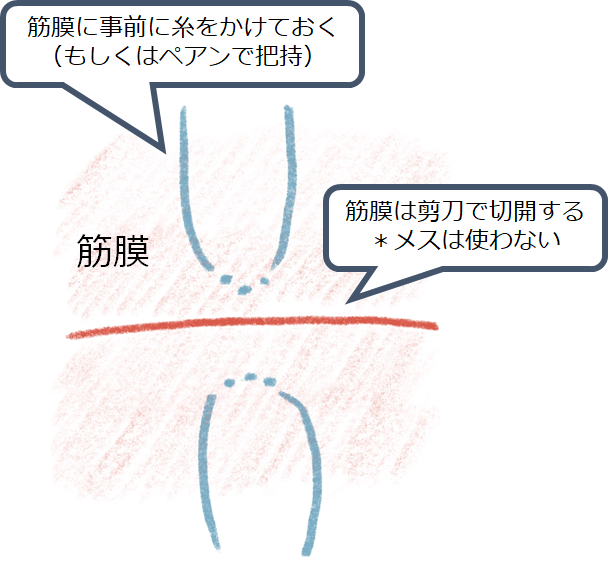
筋膜に切開を入れる際は攝子で持ち上げハサミで切開をいれる。メスは使用しない方が安全(直下の筋組織を傷つけてしまう可能性があるため)。筋膜には麻酔は効いていないため疼痛があるため、患者さんに声をかけながら行う。必要あれば静脈からの鎮痛薬、鎮静薬を追加する。切開した筋膜の端はペアンで把持しておく(図では上下それぞれ3箇所)。筋線維を露出させる。
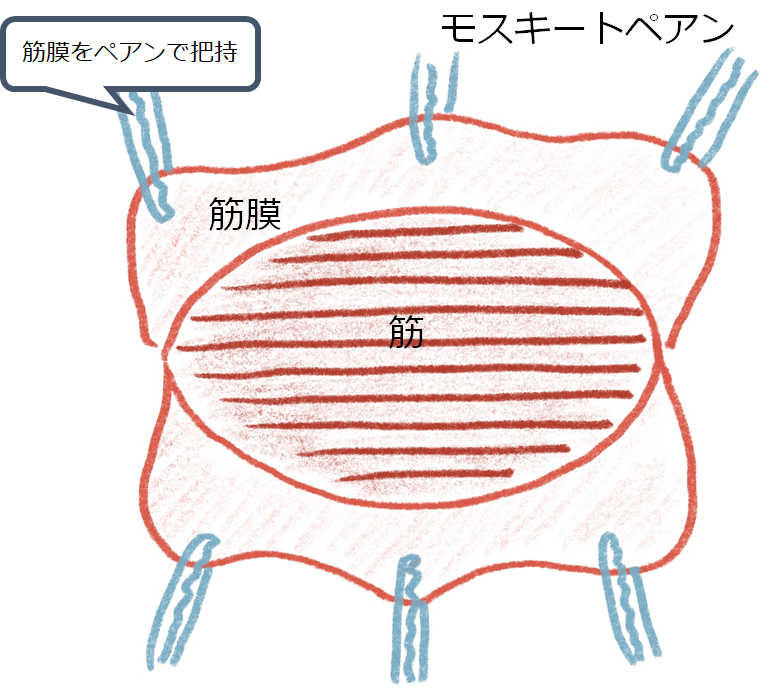
5:筋採取
ペアンで筋組織を鉛筆の太さくらい剥離し、曲がりペアンで採取のため浮かせる。このときもかなり痛みがあるため患者さんの疼痛には配慮する。1cm程度の長さを確保し、両端をハサミで切断して検体を採取する。事前に筋にかるく糸をかけておき、筋がどこかへ行ってしまわないようにする方法もある(糸できつくしばると組織が損傷してしまうため注意)。一気に切ると筋がぎゅんと収縮して端がわからなくなってしまうため、少しずつ切ると良いと教科書には書いてある。検体は生理食塩水に浸し固く絞った濡れガーゼでくるみ運ぶ(びちゃびちゃのガーゼではだめ)。
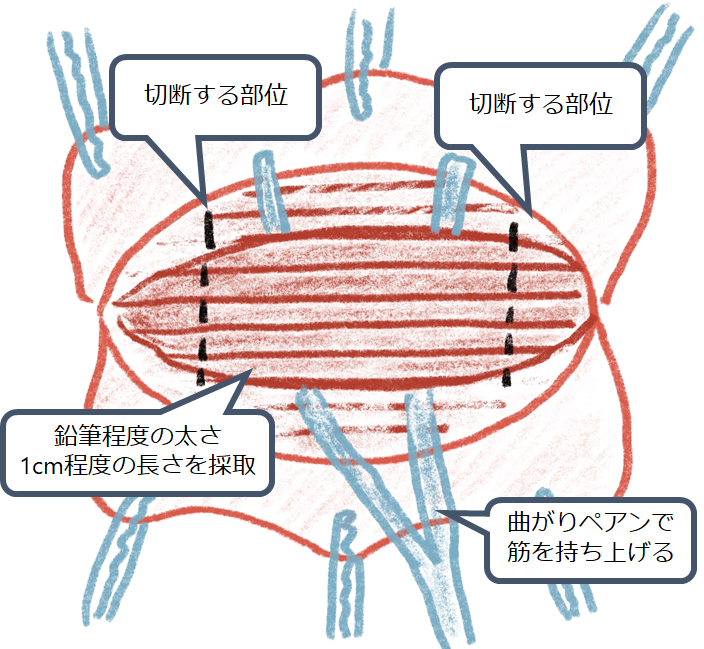
*個人的な経験では筋生検では創部が広すぎ、検体を取りすぎのことが一般的に多い印象があり注意です。逆に神経生検では切開創が小さすぎ、検体が短すぎることが多い印象があります。
6:閉創
筋膜を4-0PDSで縫い合わせる。このとき筋膜の場所がわからなくなってしまわないように事前にペアンで把持しているもしくは糸をかけているはずなのでこれを参考にする。真皮縫合を行い、最後の表皮縫合を行う。
自分の忘備録のためにかんたんにまとめさせていただきました。この他にも注意する点などに関してコメントやご意見をいただけますと幸いです。
検体処理
1:凍結標本:最重要
・コルク片の上にトラガガンドゴムにより土台を作成し(中央に筋肉を入れるためのくぼみを作る)・筋肉を立てる(筋束がコルクに対して垂直になるようにする)
・ビーカーの中にイソペンタンを入れ、ビーカーを液体窒素内へ浸す。イソペンタンが十分に冷えると白い結晶構造がビーカー底に出来るので、このタイミングで筋の凍結を開始する。具体的にはピンセットはあらかじめ冷やしておき、コルク部分を把持した状態でイソペンタン内で素早く細かく動かす(約30秒程度撹拌する)。*急速に凍結させないと氷の結晶ができてしまう。
*なぜ直接液体窒素で凍結できないか?→直接検体を液体窒素に入れてしまうと気化した空胞により悪影響が出てしまうため
・クリオスタット内でイソペンタンを揮発させる(教科書的には1時間程度と記載)
・クリオスタットで凍結切片を作る
・染色作業を行う
2:ホルマリン固定標本:小さいものをホルマリン固定用へ
3:電子顕微鏡用:グルタールアルデヒド
解釈
こちらの記事をご覧ください。