EGPAは膠原病科だけでなく神経内科でも診療することが多い疾患で私の外来にもEGPAでフォロー中の方が数人いらっしゃいます。疾患に関してかんたんにまとめます。
病態
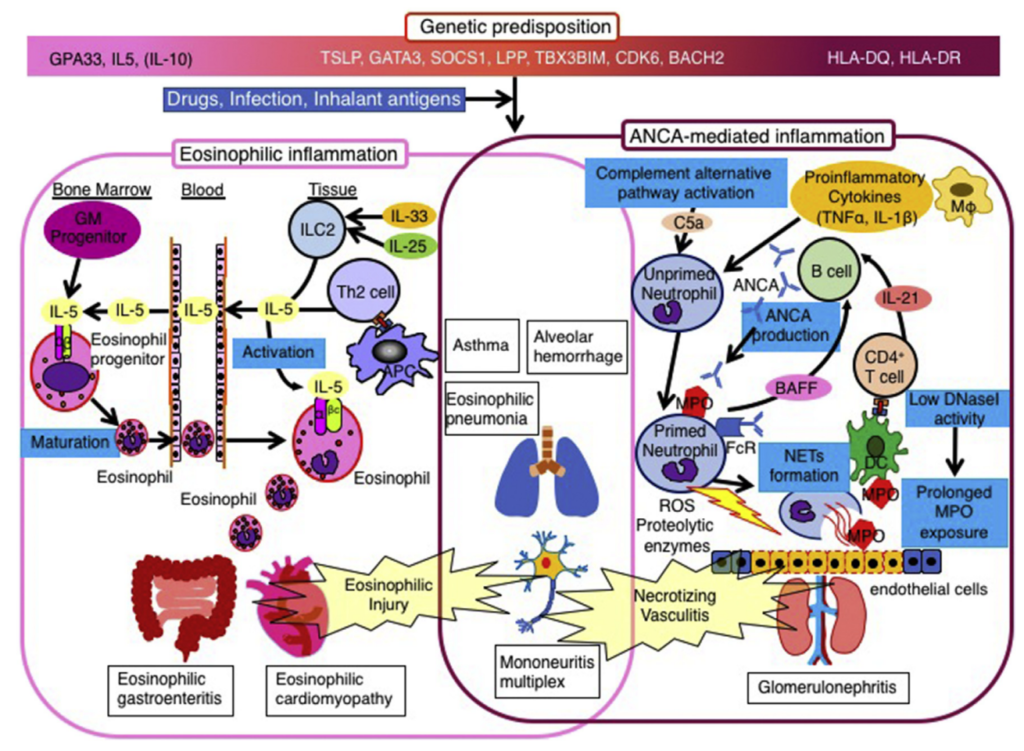
・2012年改訂Chapel Hill分類で小型血管炎のうちANCA関連小型血管炎に分類され、もともとCSS(Churg-Strauss syndrome)とされていたものと同一疾患です。難治性喘息として呼吸器内科医が、血管炎として膠原病科医が、末梢神経障害として神経内科医が診療することのある多臓器に障害を呈する疾患として重要です。
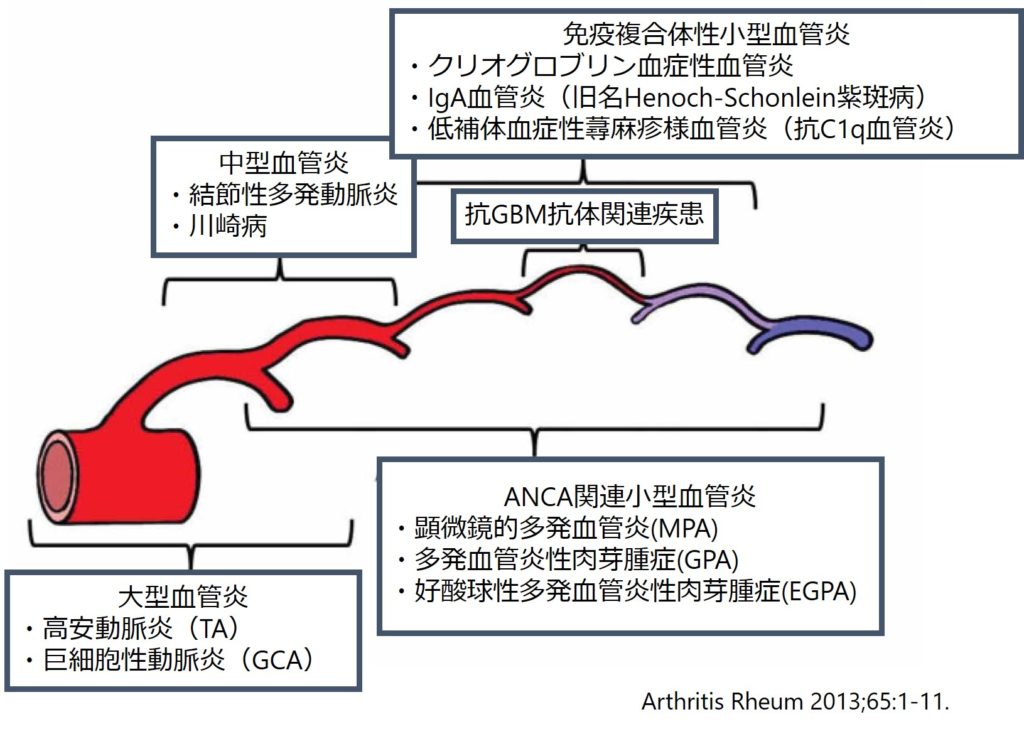
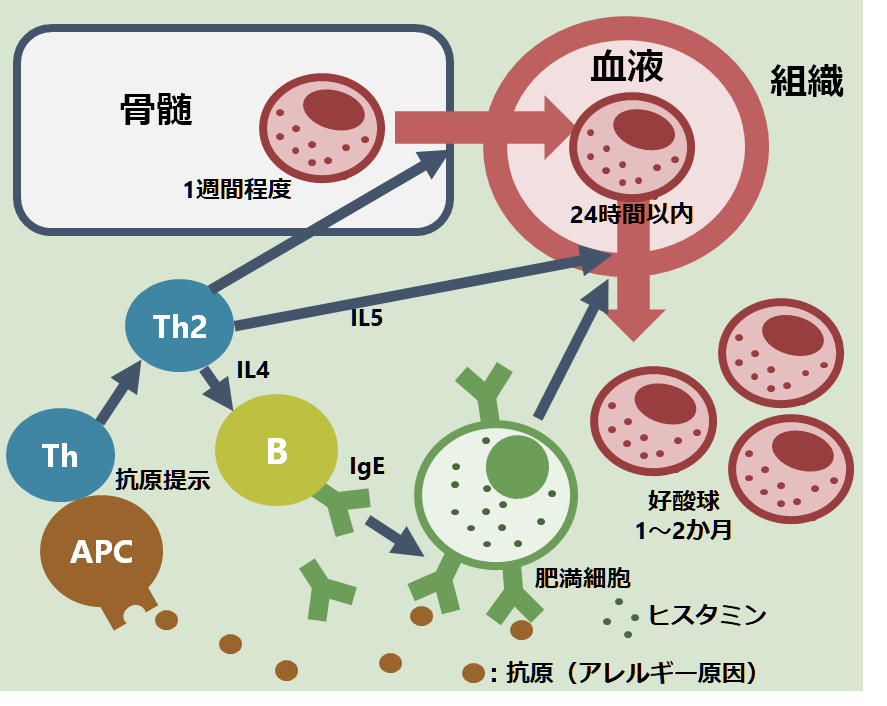
・特にANCA関連血管炎と好酸球増多(HES)の両者が病態に関与しており、ANCA陽性例と陰性例で臨床像も異なることが指摘されています(下図J. Clin. Med. 2018, 7, 529より引用)。MPO-ANCA陽性例は約半数程度であり、他のANCA関連血管炎と違う点でもあり注意です。
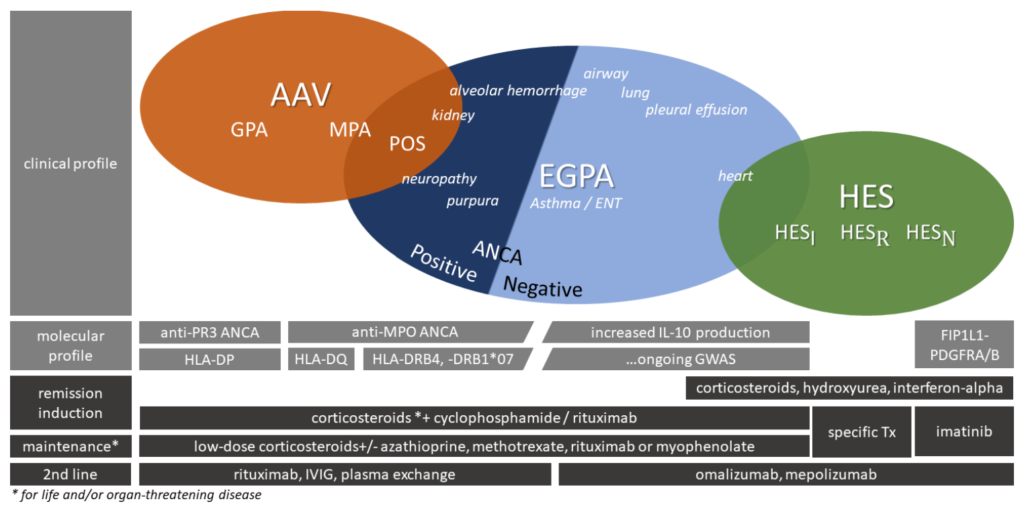
下図はAllergology International 68 (2019) 430e436より引用。
*ANCA陽性例と陰性例での臓器障害の違い A Systematic Review and Meta-Analysis. J Allergy Clin Immunol Pract. 2021 Jan;9(1):445-452.e6.
ANCA(+):末梢神経障害・腎障害
ANCA(-):心筋障害・肺障害
*ANCA+は血管炎の病態、ANCA-は好酸球脱顆粒の病態
臨床像
・気管支喘息が先行(ほぼ全例に近い)して、その後好酸球増多を伴う全身性血管炎による多臓器障害をきたす。
*鼻病変に関して:ポリープ、篩骨洞の障害により嗅覚障害を呈することが特徴
・末梢神経障害(多発単神経炎):EGPAはAAV(ANCA関連血管炎)の中で突出して末梢神経障害の合併が多い特徴があります。病態は血管炎による虚血性の軸索障害です。急性、左右非対称、多発単神経障害のパターンをとり、一般的に遠位、また背屈が障害されやすい(結果drop hand, drop footを呈することが多い)とされています。また疼痛を伴う場合も多い点が特徴として挙げられます。
*末梢神経障害の緊急疾患は血管炎性ニューロパチーとギランバレー症候群の2つです。血管炎性ニューロパチーに関してはこちらにまとめがあるのでご参照ください。本疾患は末梢神経障害から発症する場合もあり、神経内科医が治療にあたることも多い疾患です。早期の治療介入が何よりも機能予後には重要なので、可能な限り早急に神経伝導検査、また神経生検を行い治療介入へ踏み切ることが重要です。
・心筋障害:予後規定因子として重要
・腎障害:MPA, GPAよりも頻度は低い
検査
他疾患の除外と臓器障害合併評価目的に行う。
・採血検査:末梢血塗抹像(好酸球)、IgE、アスペルギルス抗原
*好酸球増多の鑑別に関してはこちらにまとめがあるのでご参照ください。
・尿検査:尿沈渣で糸球体腎炎を示唆する所見があるかどうか?重要
・胸部レントゲン、CT検査、呼吸機能検査:肺病変と喘息の評価
・心エコー検査、心電図、BNP, Troponin:心筋障害の評価目的
*以下は必要時に実施
・消化管内視鏡/造影CT検査:消化管病変
*組織生検
・神経伝導検査・神経生検
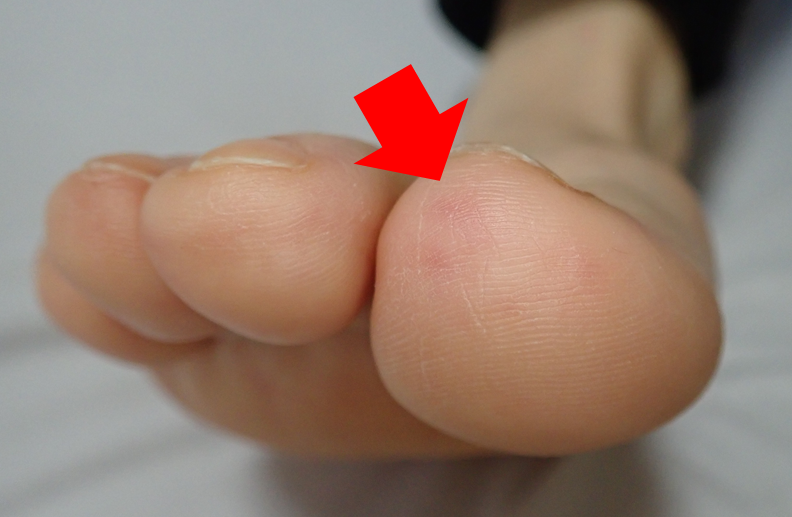
・皮膚生検:紫斑が指摘できれば同部位の生検が最も侵襲性は低い。下図は自験例の母指紫斑(同部位生検により診断)。
診断基準 日本(厚生労働省)
1.主要臨床所見
(1)気管支喘息あるいはアレルギー性鼻炎
(2)好酸球増加
(3)血管炎による症状:発熱(38℃以上、2週間以上)、体重減少(6か月以内に6kg以上)、多発性単神経炎、消化管出血、多関節痛(炎)、筋肉痛(筋力低下)、紫斑のいずれか1つ以上
2.臨床経過の特徴
主要臨床所見(1)、(2)が先行し、(3)が発症する。
3.主要組織所見
(1)周囲組織に著明な好酸球浸潤を伴う細小血管の肉芽腫性又はフィブリノイド壊死性血管炎の存在
(2)血管外肉芽腫の存在
4.診断のカテゴリー
(1)Definite
(a) 1.主要臨床所見3項目を満たし、3.主要組織所見の1項目を満たす場合
(b) 1.主要臨床所見3項目を満たし、2.臨床経過の特徴を示した場合
(2)Probable
(a) 1.主要臨床所見1項目及び3.主要組織所見の1項目を満たす場合
(b) 1.主要臨床所見を3項目満たすが、2.臨床経過の特徴を示さない場合
5.参考となる所見
(1)白血球増加(≧1万/µL)
(2)血小板増加(≧40万/µL)
(3)血清IgE増加(≧600 U/mL)
(4)MPO-ANCA陽性 *ANCA陽性は必須項目ではない点に注意が必要(治療開始にあたりANCAの結果を待つ必要はない)
(5)リウマトイド因子陽性
(6)肺浸潤陰影
どの組織を生検するべきか?
紫斑などがあれば皮膚は侵襲度が低いため良い選択しとなりますが、それらを認めない場合は末梢神経をbiopsyする場合も多いです。
重症度評価: “Five-Factor Score”
“FFS 2009”
1:重症の心病変
2:重症の消化管病変
3:腎不全 Cre≧1.7 mg/dL
4:高齢発症(≧65歳以上)
5:耳・鼻・喉症状がない
5年死亡率:0点→9%、1点→21%、2点→40% Medicine 2011;90:19より引用
これはあくまで生命予後に関する基準であり、これ単独で治療強度を決めるべきではない。ここには末梢神経障害は含まれていないが、末梢神経障害は機能予後に影響を与えるため注意が必要。
治療
初期治療(寛解導入療法):ステロイド±シクロフォスファミド
・EGPAはその疾患の特殊性から他の血管炎とは分けて臨床試験が行われてきた経緯があり、確立した初期治療法が存在する訳ではないが、一般的にステロイドから治療を開始する場合が多い。
・ステロイドの投与量に決まりはなく、臓器障害によるが、ステロイドパルス療法→プレドニゾロン1mg/kg/日を投与して適宜漸減していく場合が多い(特に末梢神経障害の場合)。
・特に末梢神経障害の場合は”emergenecy”なので可能なかぎり早くから導入するべきで、可能であればステロイド導入前にやはり生検・組織診をするべき(これは特にステロイドでの治療反応性が悪かった場合に最初の組織所見が重要となるため)。
維持療法:ステロイド±免疫抑制剤(アザチオプリン、メトトレキサートなど)
・ステロイド減量中に再燃を来しやすく(全体の約20-30%が再燃するとされている)、長期的な再発予防が必要となる。しかし、一部ステロイドをOFFにできる症例も存在する(自験例もあり)。
・しかしステロイドが高用量になると副作用の問題もあり後述のmepolizumabがsteroid-sparing agentとして維持療法で重要である。
抗IL-5抗体:メポリズマブ(mepolizumab) 商品名:ヌーカラ皮下注射
1回300mgを4週間ごとに皮下注射
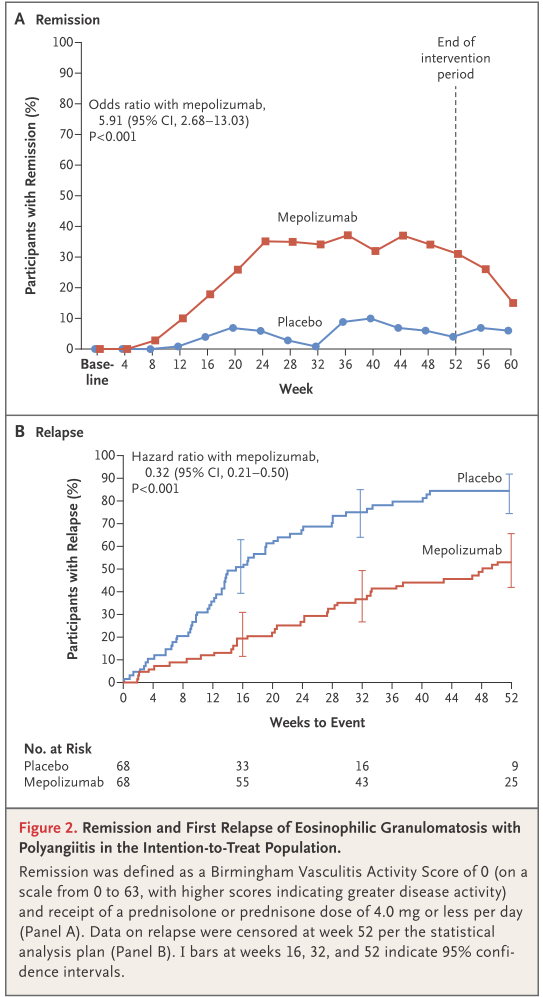
■EGPAでのメポリズマブに関するRCT MIRRA試験 NEJM 2017;376:1921
患者背景:EGPA患者で経口ステロイド治療 136例、多施設共同
治療介入:メポリズマブ300mg 4週間おき皮下注射 計13回投与
対称群:プラセボ投与
主要評価項目:52週間投与期間における累積寛解維持期間、36. 48週時の寛解率
患者背景:ANCA陽性率9-10%、PSL中央値 11-12mg/日、BVAS>0:54-71%、平均罹病期間5.2-5.9年
*ポイント:開始時のステロイド量が20mg/日では分からず軽症から中等症での導入となっている
どのタイミングからmepolizumabを導入するか?
・上記の通りSteroid sparingとしてmepolizumabの位置づけはとても重要
・急性期治療の後早期から導入
・PSL5mg/日を目標とする*実際にsteroid freeとできる症例もある
参考文献
・Allergology International 68 (2019) 430e436 EGPAに関してよくまとまったreviewです。