今まで原因不明の脳炎とされてきたものの中に自己免疫性脳炎が多く含まれていることが分かり、抗NMDA受容体脳炎をはじめとして多くの自己抗体とそれに対応する病態が解明されてきました。ここでは自己免疫性脳炎の全体像を解説します。過去にNEJM, Lancet Neurologyに素晴らしいreviewがあるため、そこから多く引用させていただきました。
病態
■細胞表面抗原と細胞内抗原の違い
自己免疫性脳炎を考える上で、自己抗体が認識する抗原が「細胞表面抗原か?細胞内抗原か?」を分けて考えることが治療効果を判定する上でも重要です。細胞表面抗原の場合は抗体介在性で免疫治療に反応しやすいですが、細胞内抗原の場合は細胞障害性T細胞が関与し、神経障害が起こりやすいため比較的非可逆的で免疫治療に反応しづらいとされています(あくまで傾向)。
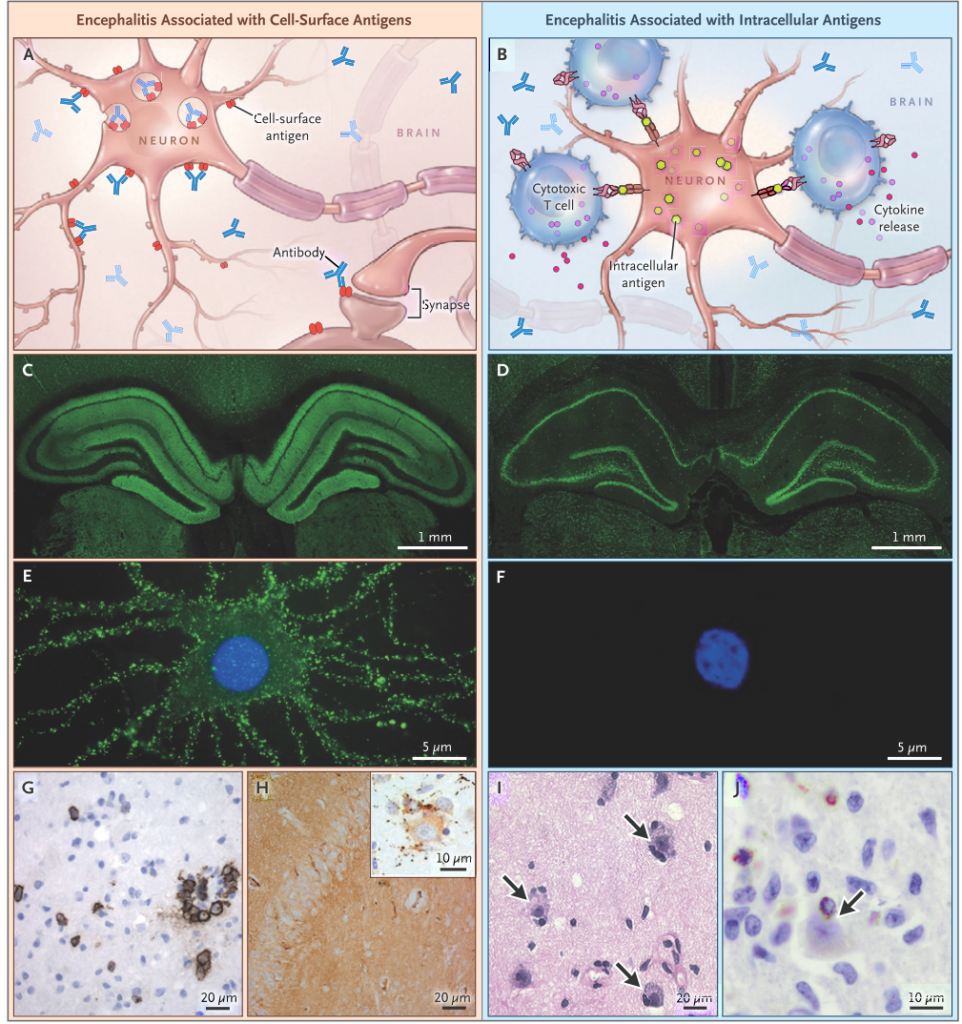
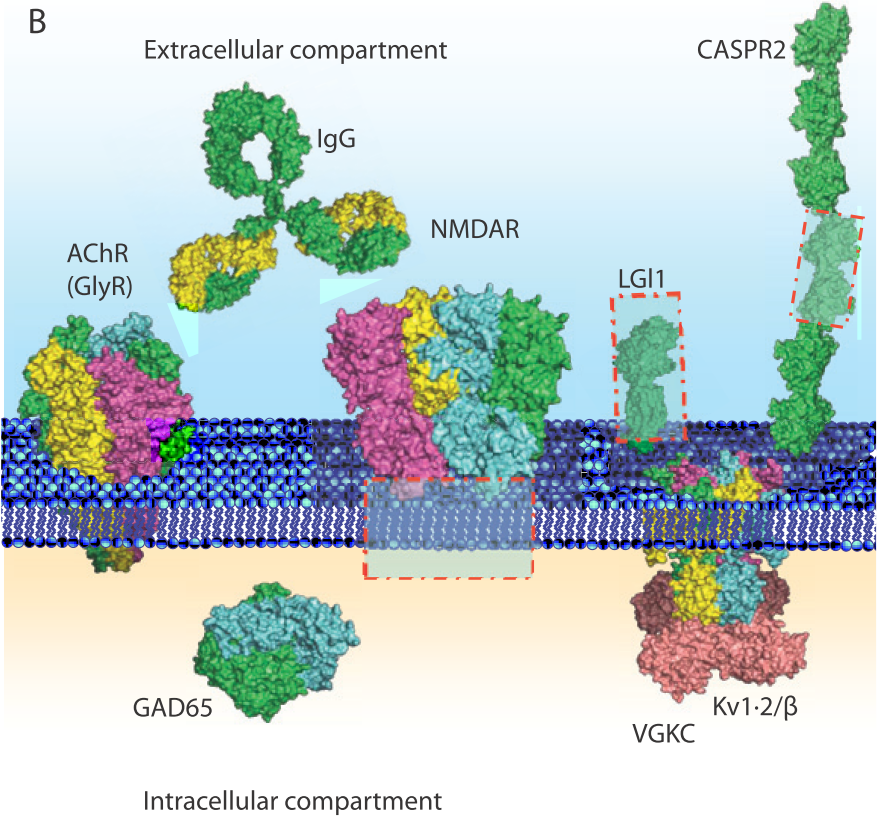
■抗体の中枢産生
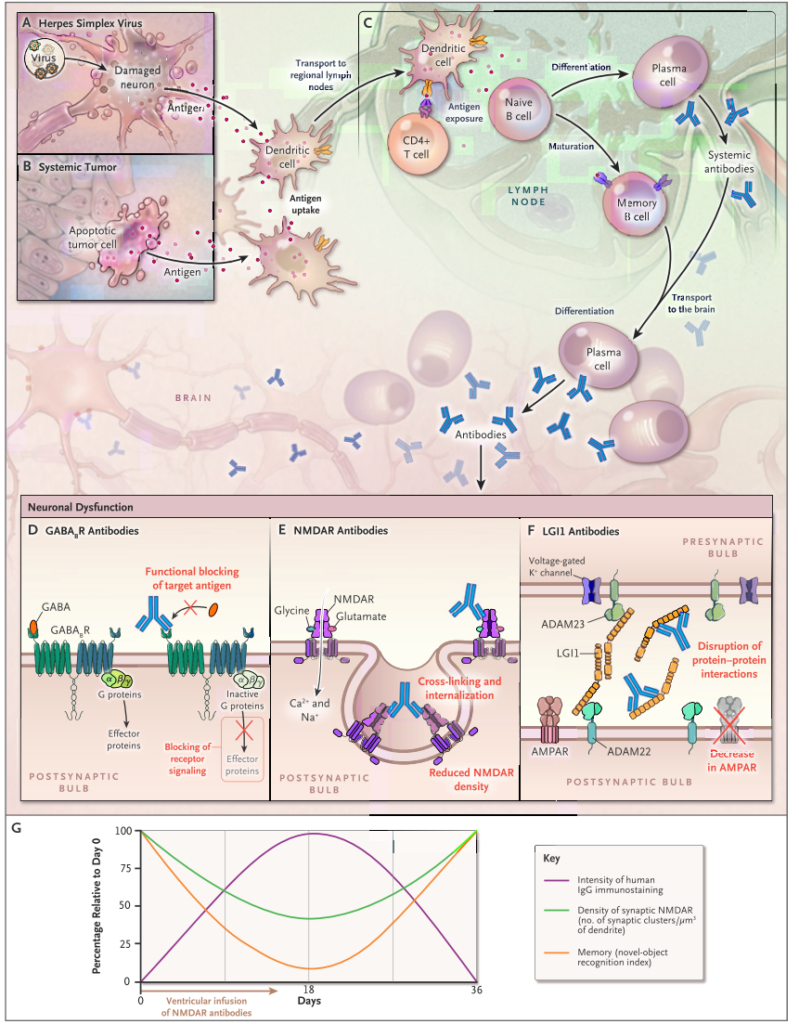
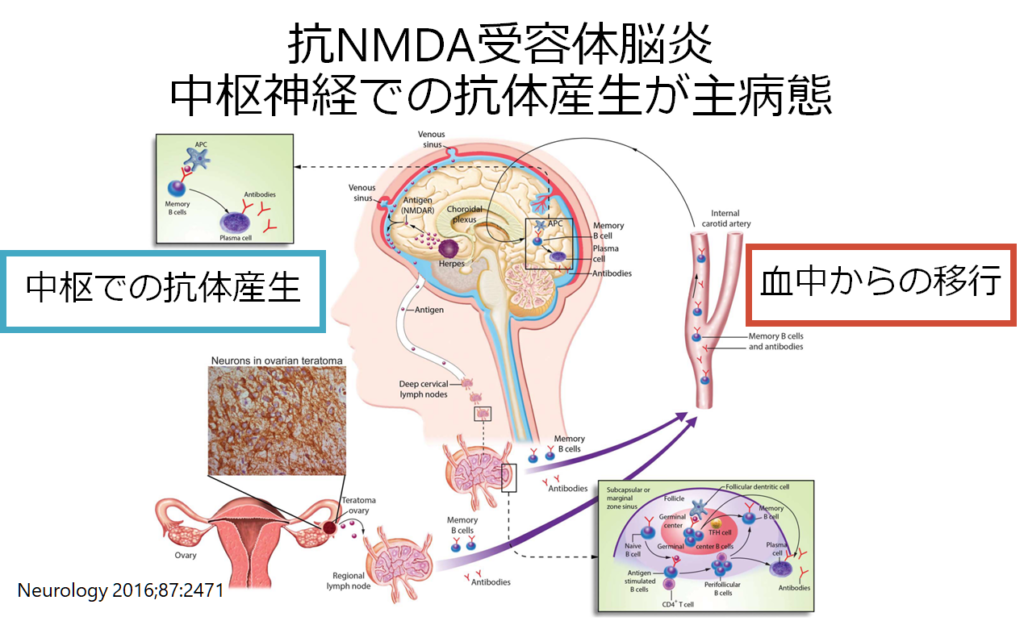
また自己免疫性脳炎の特徴として重要なのは「抗体が血液中ではなく中枢神経内で産生される場合がある」ということです。下図は抗NMDA受容体脳炎の剖検例ですが、中枢神経の血管周囲やVirchow Robin腔、間質に形質細胞があり中枢神経での抗体持続産生を示唆する所見です。
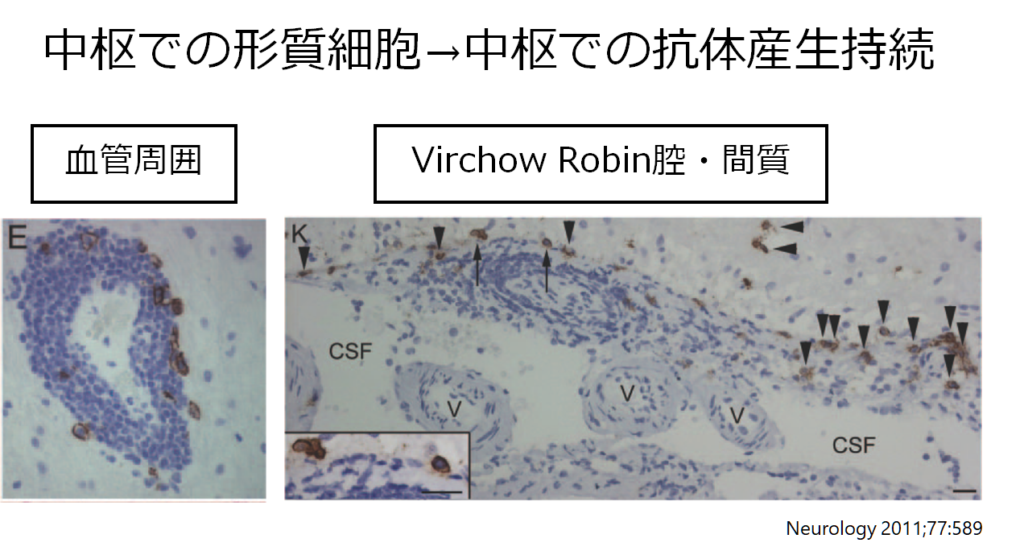
重症筋無力症は抗体が血液-リンパ節中で産生されて、抗原-抗体反応を引き起こすため、血漿交換で抗体を除去するとすぐに治療効果が現れます。しかし、一度中枢神経内で抗体が産生されると治療薬がそこにアプローチするためにはBBBを超えなければならず効果が限定的です。下図に各抗体に関して中枢産生(intrathecal synthesisと表現します)があるか?を含めたまとめを掲載します。
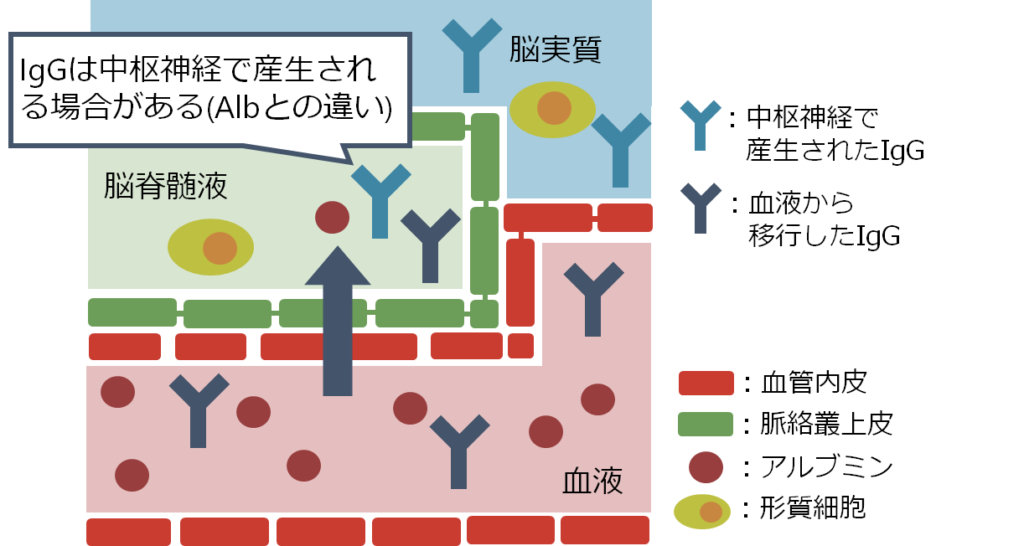
抗NMDA受容体脳炎は抗体産生部位が当初は血中-リンパ系ですが、途中から中枢産生に移行する病態が知られています。これは治療を考える上でとても重要です。
臨床像
・微熱、倦怠感、頭痛といった前駆症状を60%程度に認めるとされています。非特異的なものが多いですが、特徴的な前駆症状としては“dystonic seizures”:LGT1、下痢と体重減少:DPPXなどが挙げられます。
・抗NMDA受容体脳炎では口腔周囲の不随意運動が特徴的ですが、私が日本神経学会総会の基調講演でVincent先生が講演されていた際には「不随意運動のパターンだけから抗NMDA受容体脳炎と特定することは困難」と話されており、臨床像だけでは判断が難しい場合も多いです。
・経過は通常日から週単位の急性の場合が多いですが、慢性経過の抗体として:CASPR2, DPPX, LGI1が挙げられます。
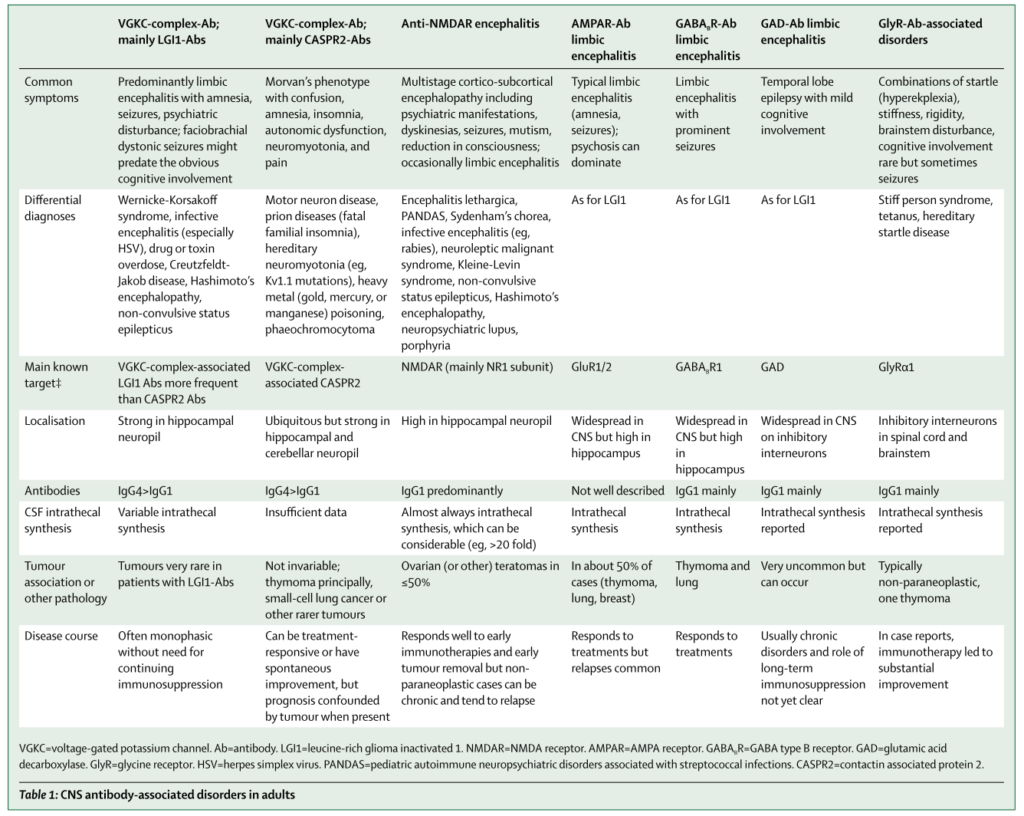
以下に抗体ごとのまとめを掲載します(NEJMより引用)。
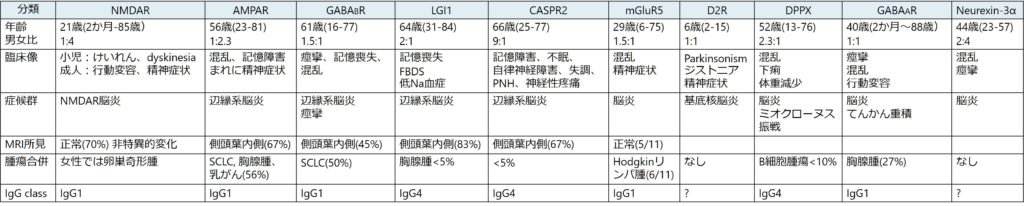
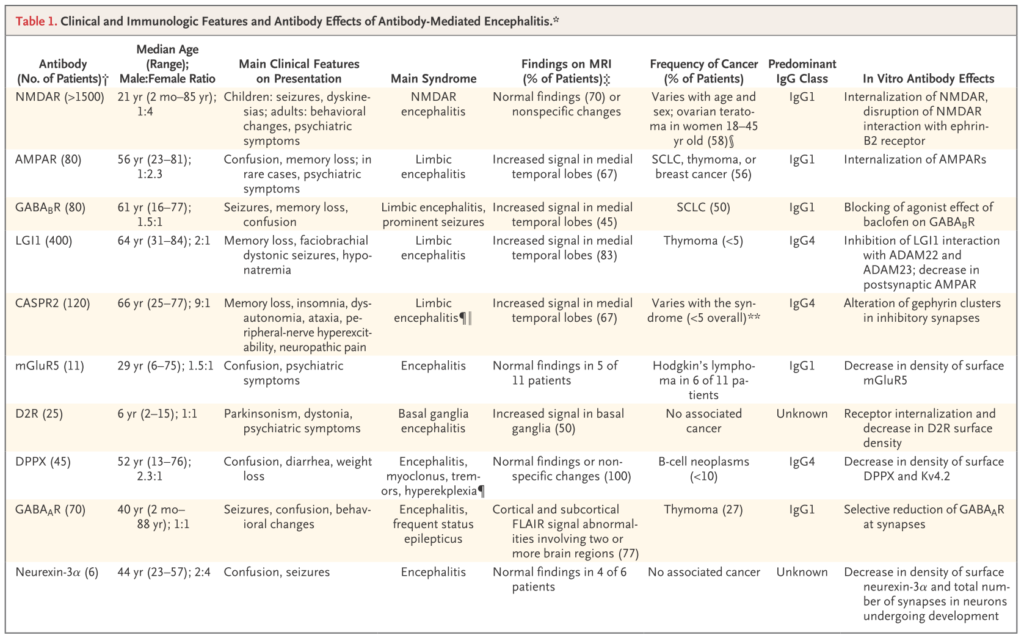
*参考:障害される脳解剖と対応する自己抗体・鑑別診断のまとめ

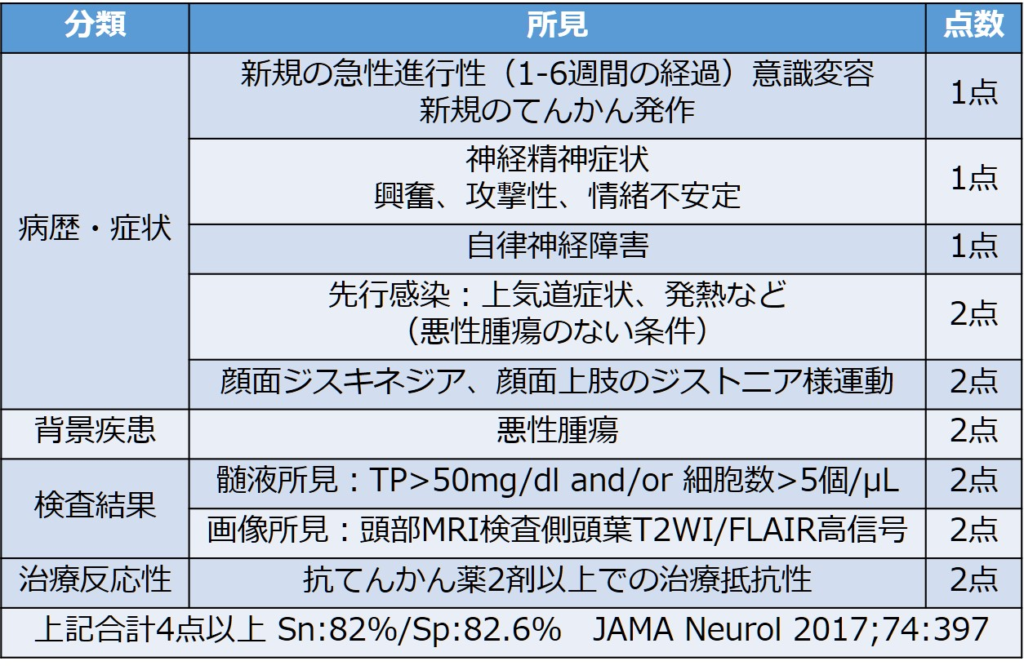
それ以外のアプローチとしては「原因不明のてんかん」からも自己免疫性脳炎を疑う必要があります。“APE score”という原因不明のてんかん患者に自己抗体を認める可能性を見積る prediction ruleがあります(JAMA Neurol 2017;74:397)。
“APE score”
・また原因不明なだけでなく、新規発症の薬剤抵抗性の難治性てんかん重積では自己免疫性脳炎が最多原因であるため、自己免疫性脳炎の検索が必要です(これはNORSEという概念に該当し、こちらにまとめがありますのでご参照いただければと思います)。自己免疫性脳炎由来のてんかん重積に対する治療として一番重要なのは「免疫治療」であり、抗てんかん薬は焼け石に水のような場合を多く経験します。
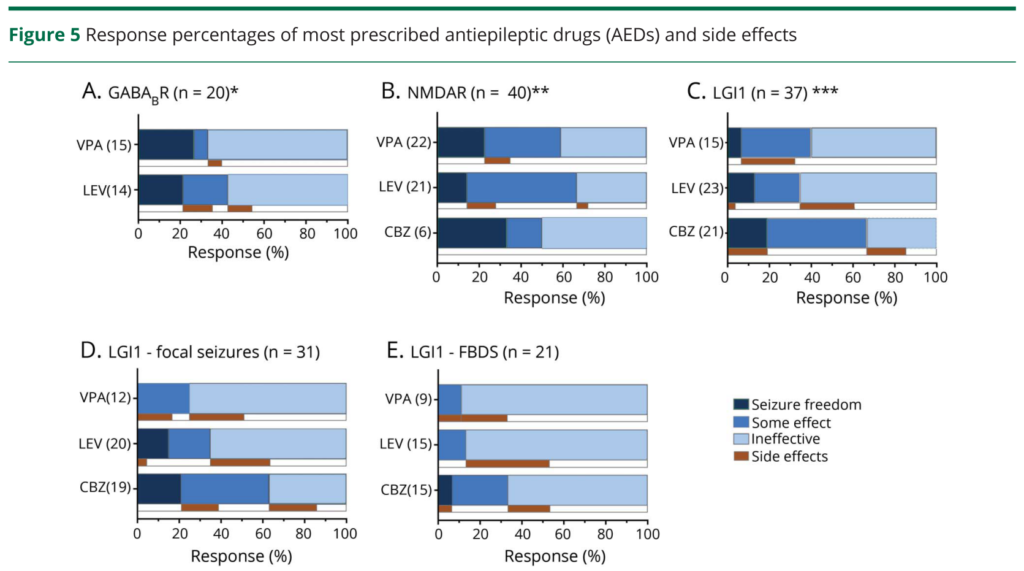
・文献的にもこの点は指摘されており、153例の自己免疫性脳炎(内訳:NMDAR75例、LGI1 53例、GABA(B)R 25例)のうち110人(72%)にてんかん発作を認め、抗てんかん薬だけでコントロールできたのは14%、免疫治療導入後すぐに改善したのは53%とされています。また薬剤開始からてんかんコントロールがつくまでの期間も抗てんかん薬だけでは59日、免疫治療では28日と自己免疫性脳炎でのてんかんコントロールにおいて免疫治療の重要性を示唆する結果でした((Neurology 2019 May 7; 92:e2185)。
検査
髄液検査
自己免疫性脳炎を疑う場合の髄液検査の解釈は以下の点に注意するべきとされています(Lancet Neurologyのreviewより引用)。
1:髄液所見正常も十分ある→髄液正常で自己免疫性脳炎を除外してはいけない(特にLGI1などは髄液細胞数正常のことが多い)
2:髄液所見正常だからといって髄液抗体産生がないわけではない、また自己抗体が検出されない訳ではない
3:抗体は髄液にて確認必要(NMDA脳炎では14%は血中抗体検出なく、髄液のみで検出することが出来る) *例外的にLGI1, AQP4抗体のみ血清で提出する
4:clinical courseは髄液中抗体価と相関する傾向がある(もちろn基本的にはclinical assessmentであり、抗体価のみで判断するべきではないけれど)
・ここからは個人的な意見です。いきなり抗体を測定せずとも、やはり髄液のIgG, IgG index, QAlbはきちんと測定することで主病態が髄腔内抗体産生かどうか?にアプローチすることが重要だと思います(IgG indexに関してはこちらをご参照ください)。自験例でもIgG indexが10を超えるような場合もあり、やはりIgG indexは高いがQAlbは正常範囲内に保たれている場合に背景に自己免疫性脳炎のような髄腔内抗体産生の病態を個人的には疑います。
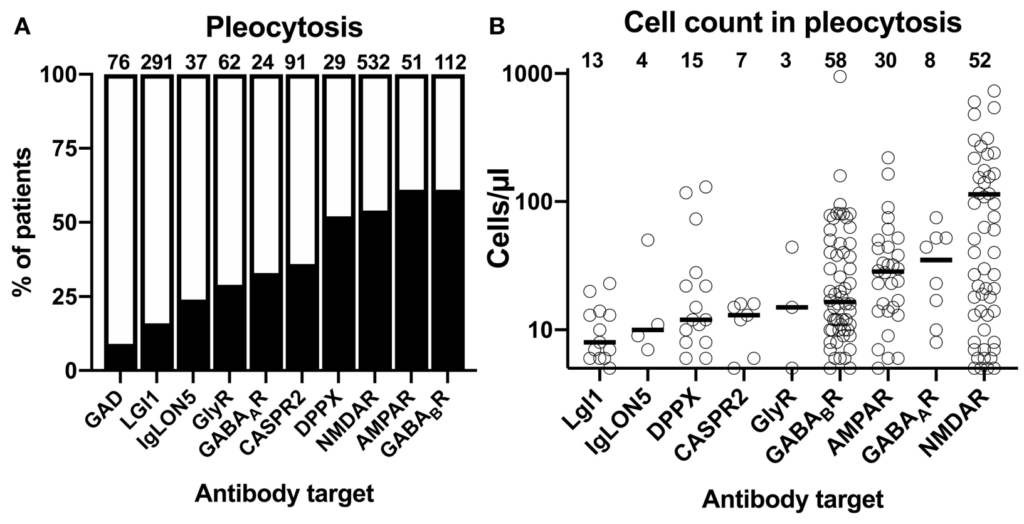
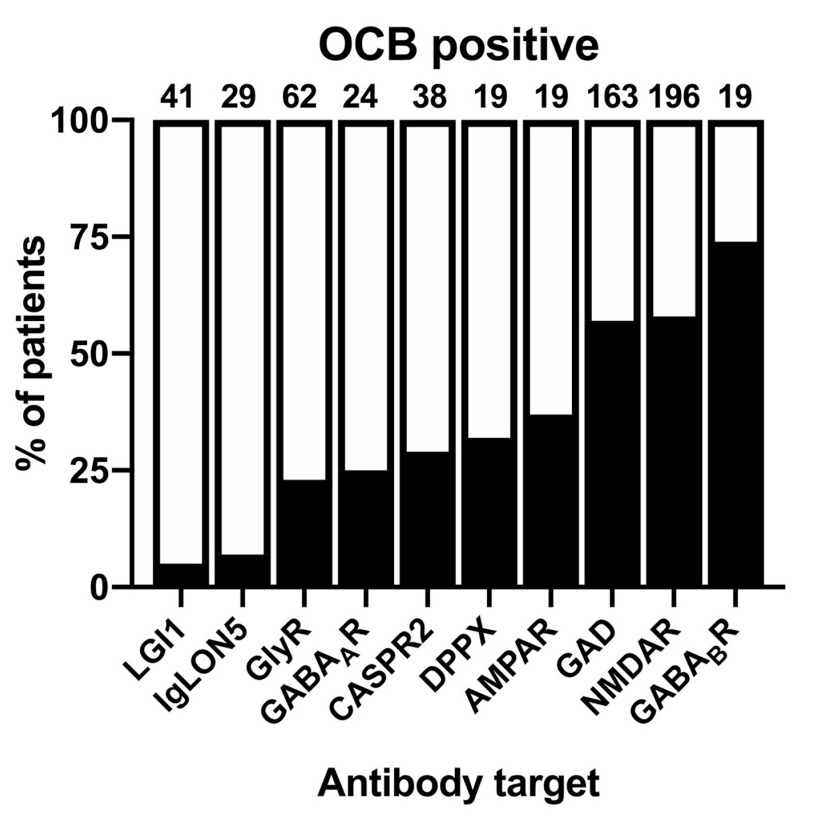
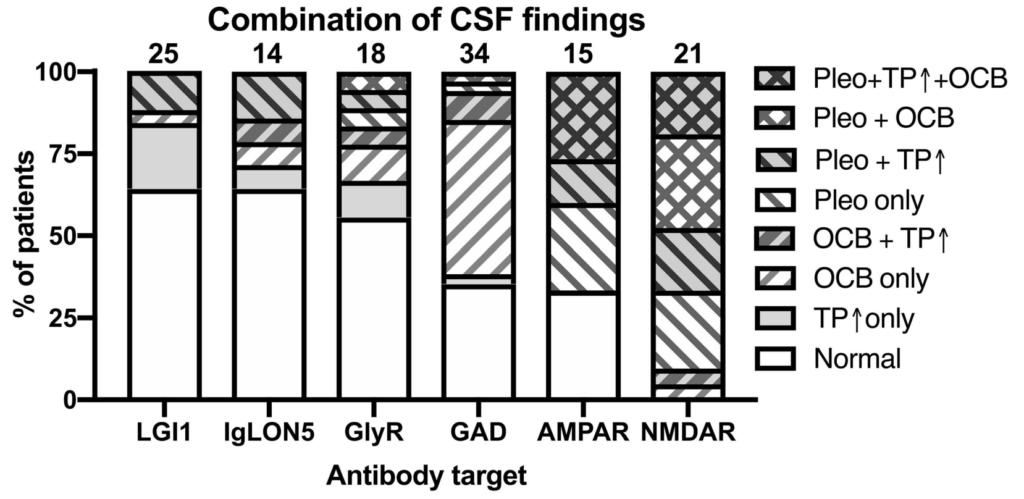
参考:自己免疫性脳炎の髄液所見・自己抗体ごとの比較 Front. Neurol. 10:804. doi: 10.3389/fneur.2019.00804
細胞数
蛋白
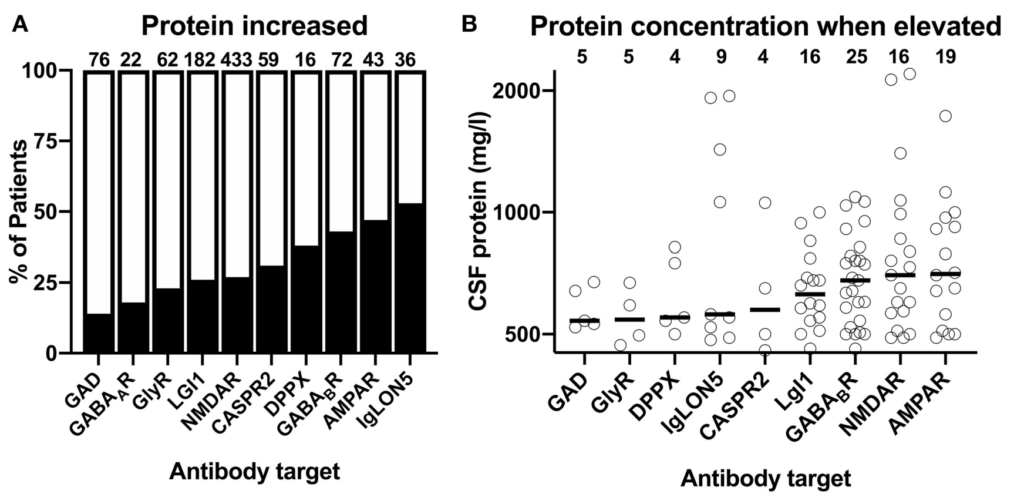
OCB+
各髄液所見の組み合わせ
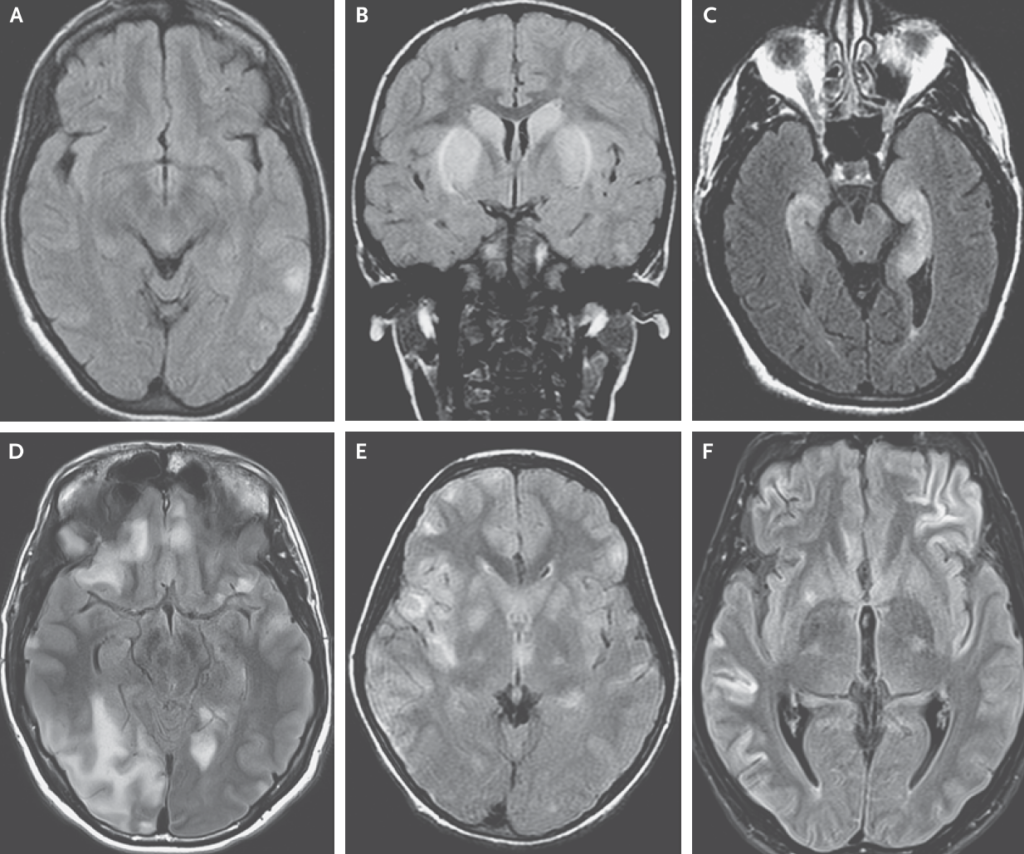
画像検査
・通常は正常もしくは非特異的な炎症所見を認めるのみの場合が多いです。
*参考:特異的な所見を持つ脳炎
・limbic encephalitis(辺縁系脳炎):側頭葉内側の高信号
・抗GABA受容体脳炎:皮質、皮質下の多発する信号変化を認める場合がある
・Dopamine 2R:小児で抗NMDA受容体脳炎疑いだが、MRIにて基底核や脳幹病変がある場合
・GFAP astrocytopathy:こちらを参照
・CLIPPERS
*LGI1,DPPXは特に細胞数正常、頭部MRI画像正常のことが多いため注意が必要とされています。
以下例(A:ほぼ正常、B:dopamine2R、C:辺縁系脳炎、D:抗GABA受容体脳炎、E:ADEM、F:AMPARと対応)
側頭葉内側の信号変化に関しては片側性の場合は注意が必要で、ヘルペス脳炎、腫瘍(glioma)なども鑑別に挙がります。以下に辺縁系脳炎の鑑別一覧を掲載します。
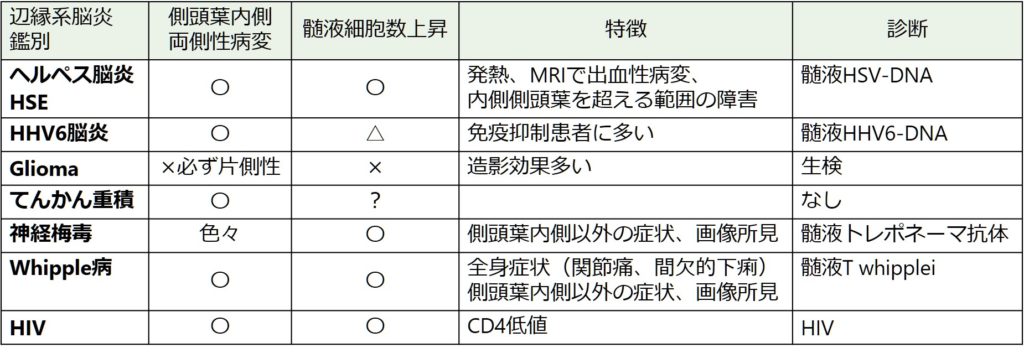
診断
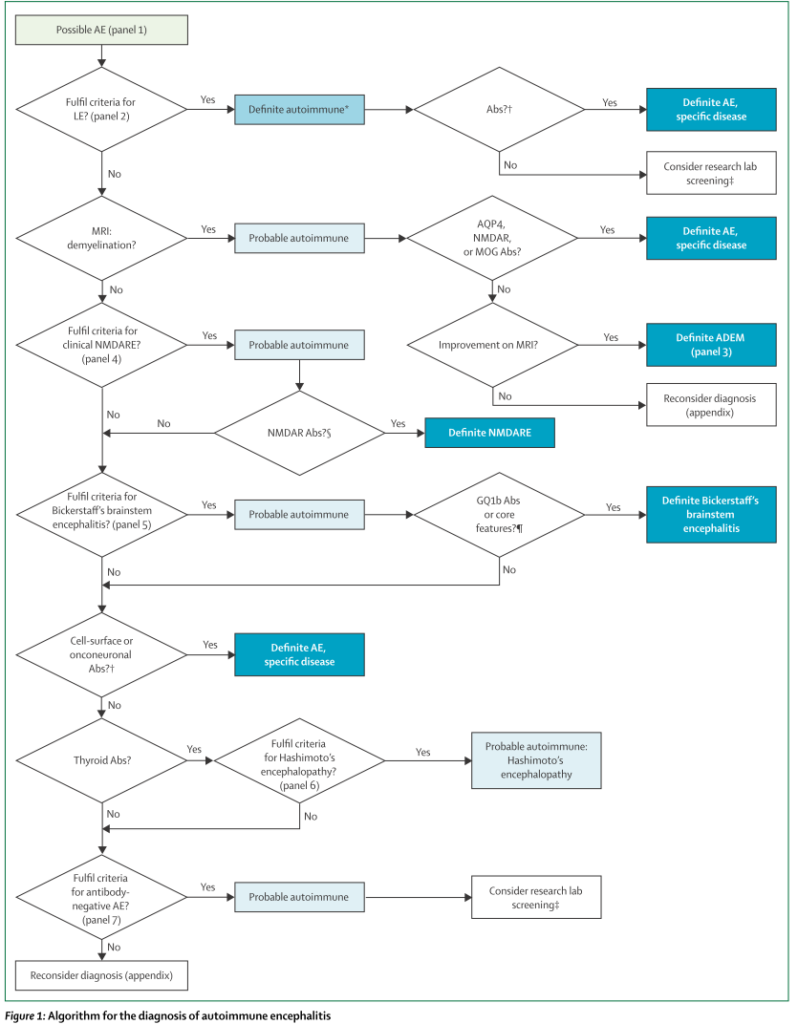
“diagnostic criteria for possible autoimmune encephalitis”
1:亜急性の経過(3か月以内)のworking memory deficit, 意識状態変容、もしくは精神症状
2:検査結果 以下いずれかを認める
・中枢神経巣症状
・Seizures 既存のものではなし
・髄液:細胞数上昇
・MRIにて脳炎を示唆する所見
3:その他原因の除外
自己免疫性脳炎の可能性がある場合”Possible AE”、そこから先は以下のアルゴリズムが提唱されています。
治療
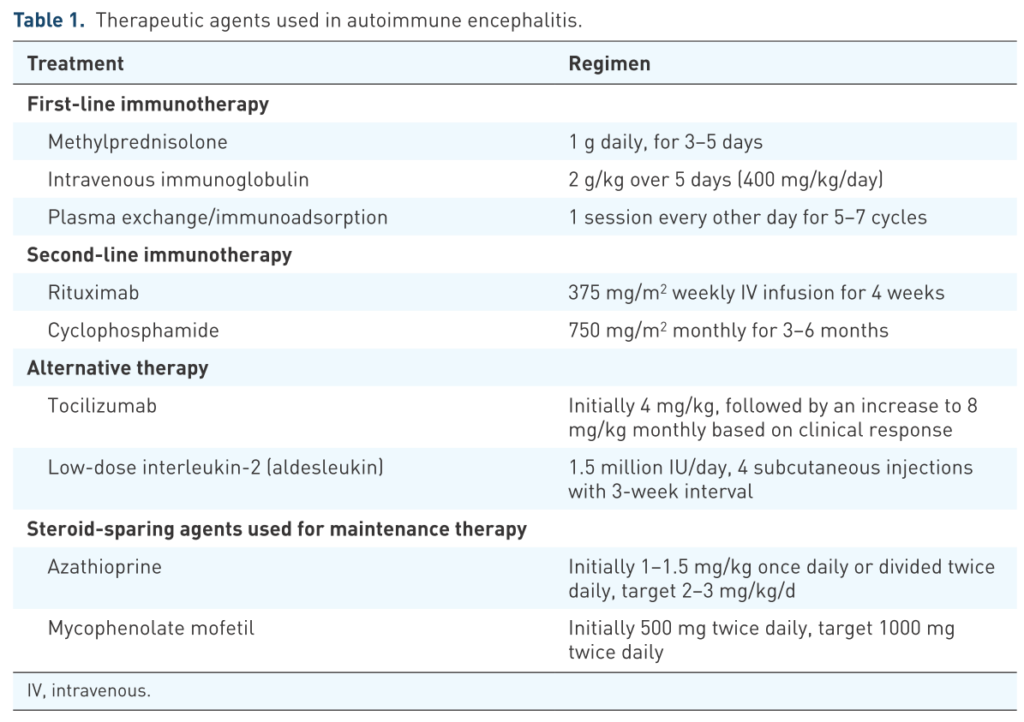
・「免疫治療」と「腫瘍除去」(腫瘍関連の場合)が2大治療として挙げられます。ここでは前者の「免疫治療」に関して解説します。まず行うべき1st line immunotherapyとしてはステロイドパルス療法・IVIg療法・血漿交換療法の3つが挙げられます。いずれもExpert opinionで前向きに検討されたものはありません。重症筋無力症は抗体が血液中にあるため血漿交換療法がすぐ効果を発揮しますが、自己免疫性脳炎では抗体産生が中枢神経で行われるため、いくら血中の抗体を除去しても効果に乏しい場合や、免疫治療がBBBを超えづらいため効果が表れにくいという難点があります。
・自己抗体の結果を待ってから免疫治療を導入することは御法度であり, PCNSLまたは神経サルコイドーシスを疑って生検が必要にならない限りは免疫治療を急ぎます。
・急性期は感染症の除外が常に必要になるため免疫治療とのバランスに常に悩むところですが、免疫治療も出来る限り遅れないようにする必要があります。
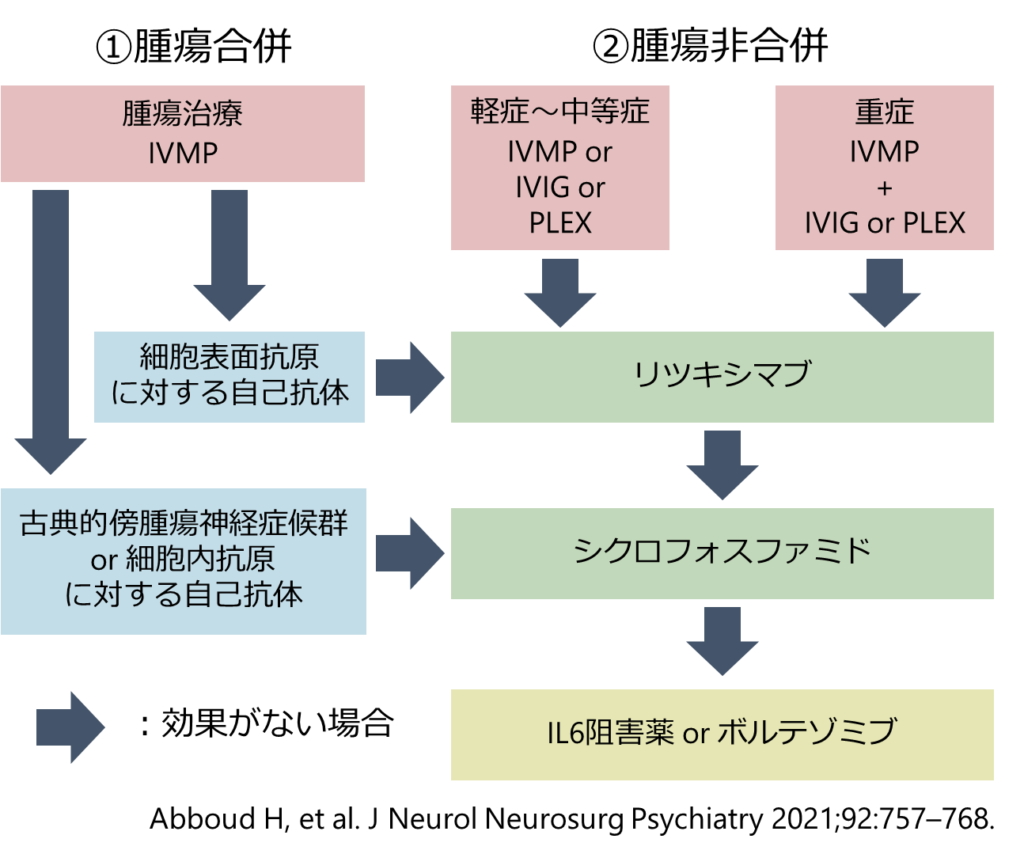
1st line therapy
■経静脈ステロイドパルス療法
・まず第1選択として開始し一般的にmPSL 1g/日を3-5日間行います。後述のIVIGと血漿交換はB細胞系の抗体に関与しますがT細胞系への関与は薄いです。この点ステロイドはT細胞系にも関与する点が特徴として挙げられます。
・ステロイドに関連する副作用としてのpsychosisと現病の精神症状の鑑別が問題になる場合があります。多くの場合まずステロイド投与から開始することが多いと思います。
・ステロイドパルスをするとLGI1, GFAP astrocytopathy, CLIPPERS, MOGなどは即効的効果が表れることが多いです。もちろんこの点だけで鑑別することは出来ませんが参考所見になります。
・傍腫瘍神経症候群は免疫治療抵抗性ですが、ICI関連の自己免疫性脳炎ではステロイド治療反応性良好です。
・ステロイドパルス療法1クールが終わるまでに改善を認めない場合は血漿交換療法または免疫グロブリン療法を追加します。
・重症例=NMDAR・NORSE・重度自律神経障害では初期から以下の血漿交換療法または免疫グロブリン療法を併用します
■血漿交換 *詳細はこちら
・重症例では初期からステロイドパルス療法と併用して治療を開始します。ステロイドパルス療法単独では治療効果不十分であることが多く併用として考慮されます。
・効果があったとする症例報告は複数ありますが、先ほども申しあげた通り髄液中で産生された抗体を血中の抗体を除去する治療ではたして効率的に除去できるのか?という問題点があります。
・ただ中枢性脱髄病変やNMOSDでは初期からの血漿交換療法が特に効果的です。
・リスクとしては出血リスク、体液量減少(特に自律神経障害患者)、中心静脈ラインが必要であること(特に興奮状態にあるなど)などが挙げられます。
・文献には隔日で5-10回実施の方法が記載されています。
■経静脈免疫グロブリン療法 *詳細はこちら
・効果発現までに時間がかかる点が難点なことと、その後に血漿交換療法をすることができない(入れた抗体をすぐに抜いてしまうことになるため)点が難点です。
・また血栓症リスク上昇の懸念がある点と選択的IgA欠損症の患者ではアナフィラキシーのリスクがあり極めて稀ではなるが抗IgA抗体を考慮することもあります。
2nd line therapy
・1st lineで効果がない場合の2nd line immunotherapyとしてはリツキシマブとシクロフォスファミドが挙げられます。出来るだけ早期から導入することの重要性が強調されています。
・具体的にどのタイミングから2nd line therapyを導入するか?に関しては1st line therapy 10日, 2週間以内, 2-4週間など文献により記載は様々です。
■リツキシマブ
・CO20を標的とするB細胞cellular toxicity,補体活性化、アポトーシス誘導により障害します。あくまで持続的に抗体産生をする形質細胞へ分化する前段階に働きかけ、CD20 negativeのlong-lived plasma cellsは標的としない(下図参照 Neurology 2008;70:2252より引用)点で持続的に抗体産生をしている中枢産生内の形質細胞にどのくらい効果があるか?は分かりません。実際には末梢血中のB細胞比率を出してから投与を検討します。
・日本では現時点で保険収載がないため実施が難しい施設が多いと思いますが、上記のアルゴリズムではほとんどの場合シクロフォスファミドよりも副作用が少ないため優先的に使用することが推奨されています。
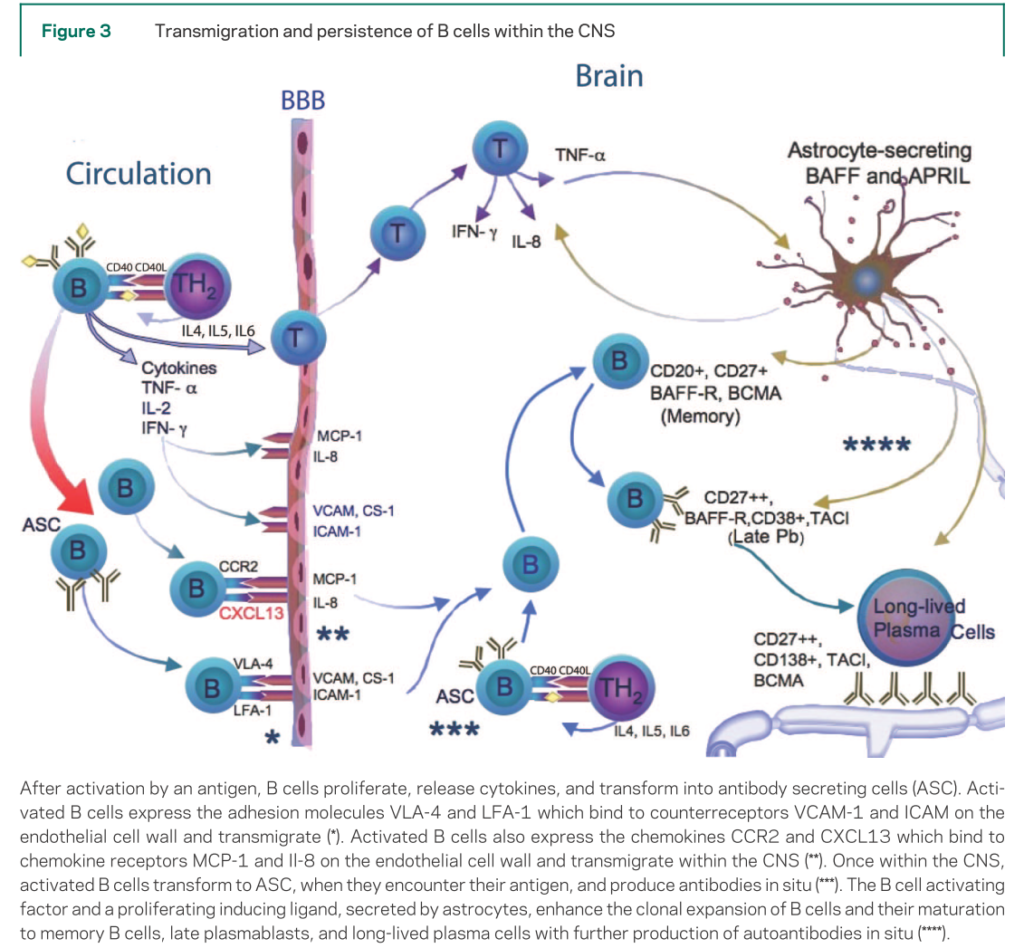
・このほかリツキシマブは髄液中のrituximab濃度は血中の0.1%程度であり、中枢神経での抗体産生を抑制する効果は不明ですが(Blood 2003; 101:466)、抗NMDA受容体脳炎に対してRituximab投与により、症状改善した症例報告は複数あります(Neurology 2008;71:1921 , Intern Med 2012;51:1585)。
■シクロフォスファミド *こちらを参照
・B,T細胞いずれも障害しますが、副作用が多い点が難点です。リツキシマブは副作用が比較的少ない利点がありますが、値段が高い点、保険適応外になる点が難点として挙げられます。
・600-1000mg/m2の投与量が記載があります。
以下に治療方法をまとめます。
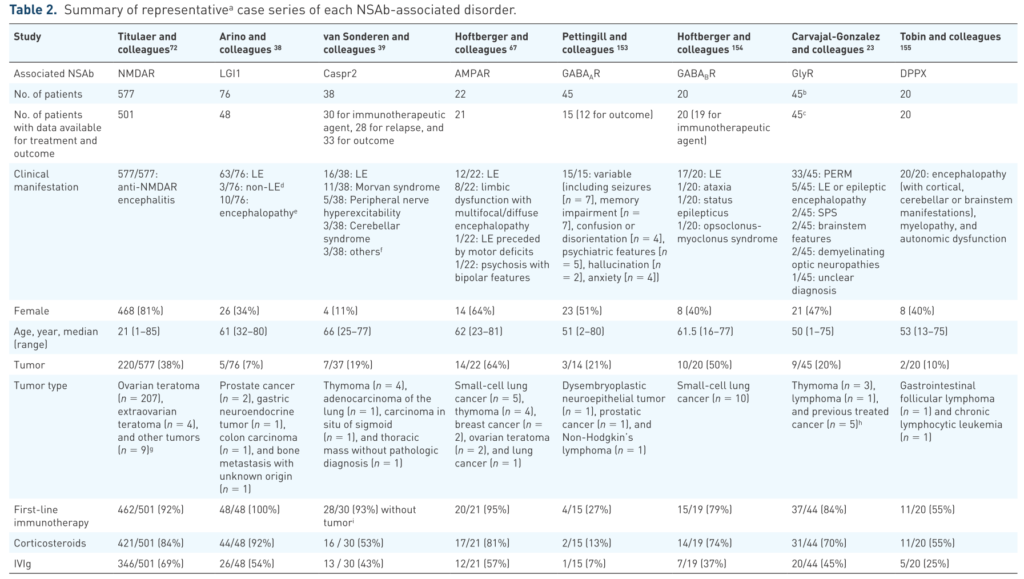
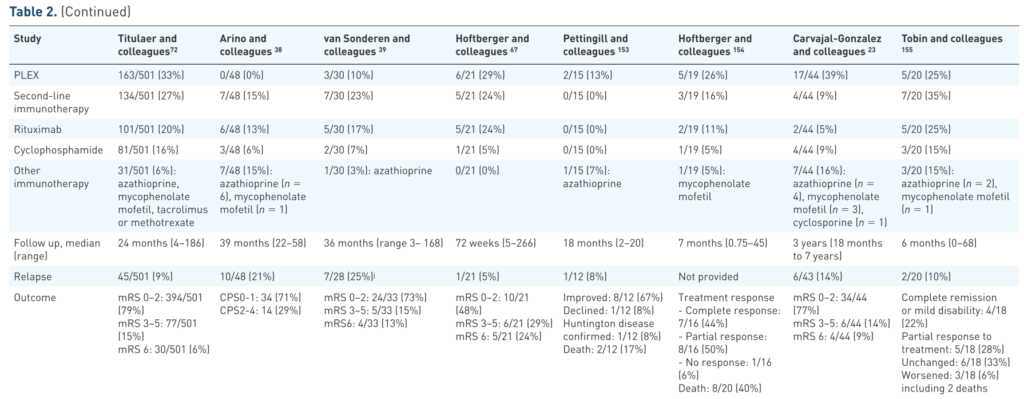
以下は具体的な治療例の報告をまとめたものになります。
参考文献
・Lancet Neurol 2016;15:391:自己免疫性脳炎への診断に主眼を置きまとめられた素晴らしいreviewです(必読)。いわゆるGraus基準です。
・NEJM 2018;378:840:自己免疫性脳炎のreviewでこの分野の世界的権威Dalmau先生が書かれていらっしゃります(必読)。分かりやすいシェーマが沢山あり多く引用させていただきました。
・Ther Adv Neurol Disord 2018;11:1:治療パートはほぼすべてここから引用させていただきました。
・Lancet Neurol 2011;10:759:特に抗体に関してまとめたものでVincent先生がご執筆されています。
・J Neurol Neurosurg Psychiatry 2021;92:757–768. 最新の自己免疫性脳炎についてのまとめで必読


