1:凝固・線溶の生理学
■外因系・内因系
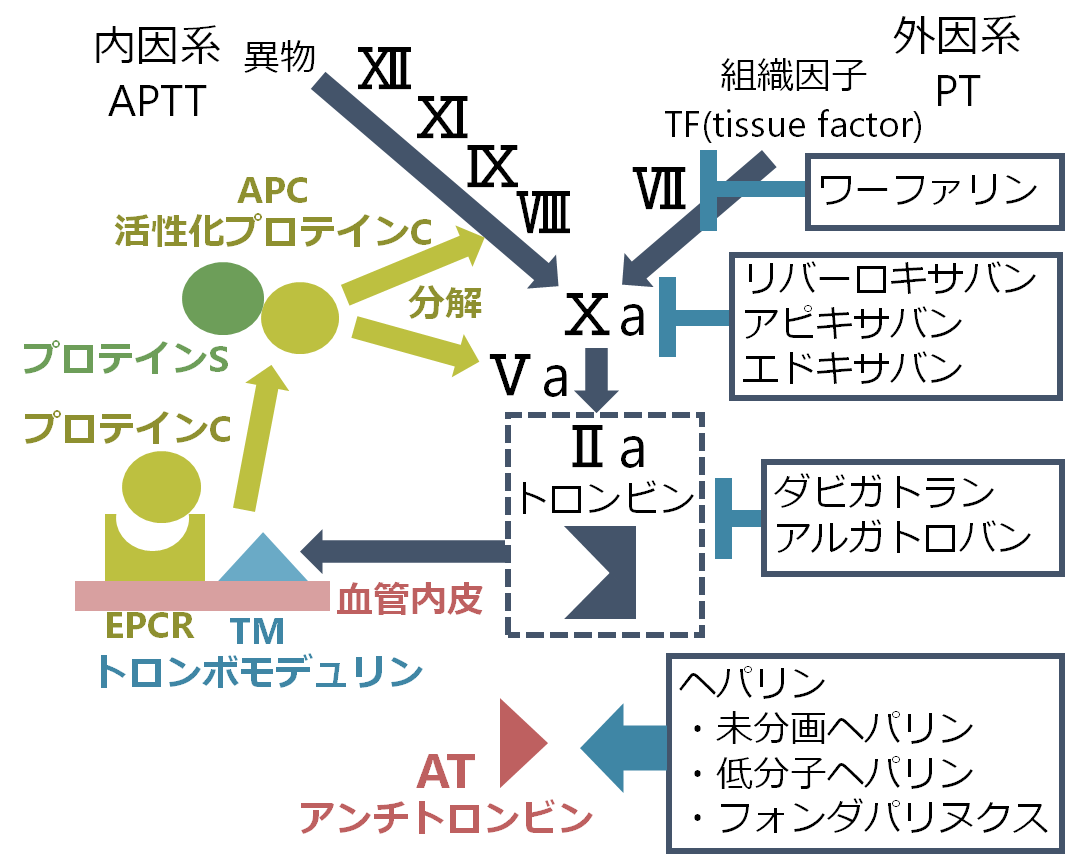
凝固カスケードは大きく内因系、外因系とそれらが合わさる共通系に分けることができます。内因系は凝固因子が全て「血管内」にあるため「内」と表現し、外因系は組織因子が「血管外」にあるため「外」と表現しています。出血時の止血では特に外因系が重要であるとされています。内因系はAPTTで、外因系はPTでそれぞれモニターします。
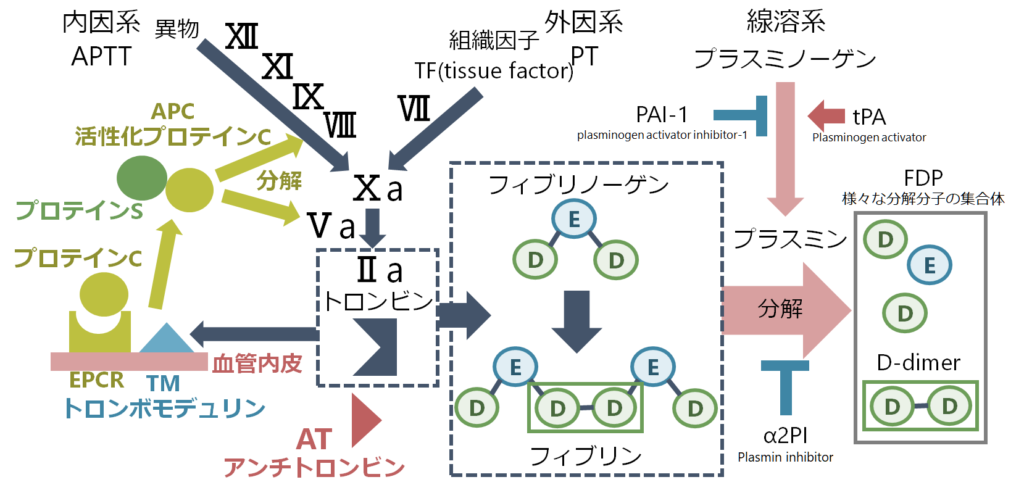
外因系、内因系それぞれが活性化すると、共通系に移行しFⅩaが活性化し、Ⅱ(プロトロンビン)からⅡa(トロンビン)が生成されます。このⅡa(トロンビン)はフィブリノーゲン(fibrinogen)をフィブリン(fibrin)にすることで止血(二次止血)を促します。採血ではこのうちフィブリノーゲン(fibrinogen)を測定することが出来ます。
■線溶系
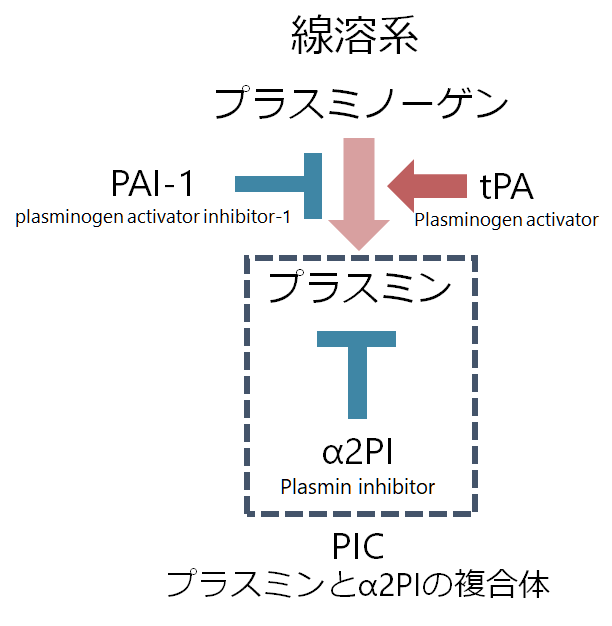
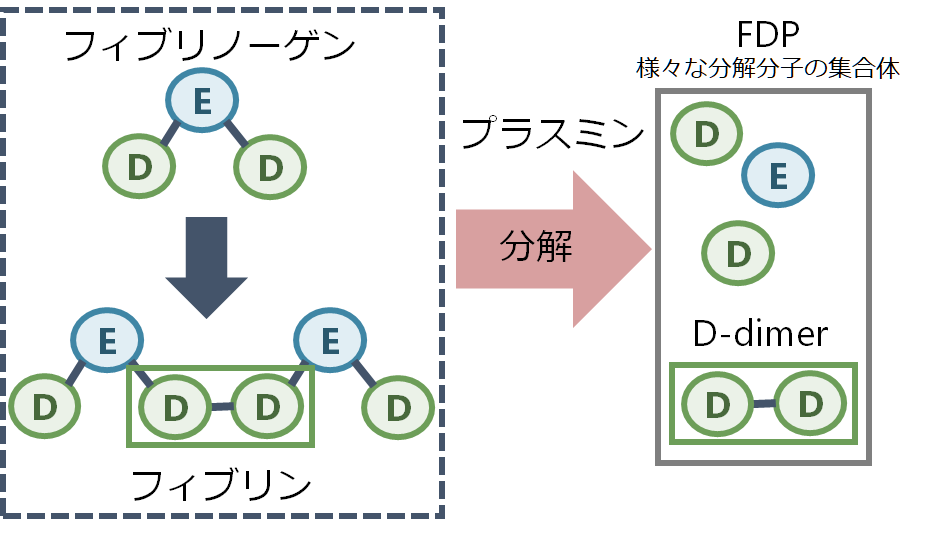
線溶系はこのフィブリノーゲン、フィブリンを溶かす機序です。血管内皮細胞から作られたtPA(tissue plasminogen activator:組織型プラスミノーゲン活性化因子)によりプラスミノーゲン(plasminogen)がプラスミン(plasmin)となり、このプラスミンがフィブリノーゲン、フィブリンを分解します。フィブリノーゲンもしくはフィブリンの分解産物をまとめてFDP(fibrin/fibrinogen degradation products)と表現し、フィブリンの分解産物の”D”domainが架橋されてペアになったものをD-dimerと表現します。
プラスミンはα2PI(plasmin inhibitor)によって阻害されます。線溶系の活性度を知るための指標としてはプラスミンが半減期が短く測定できないため、このプラスミンとα2PIの複合体であるPIC(plasmin α2 plasmin inhibitor complex)を測定することで線溶系の活性度を測定します。
■凝固系の制御機構
凝固系に対して制御機構が大きく2経路あります。
1:ATの経路
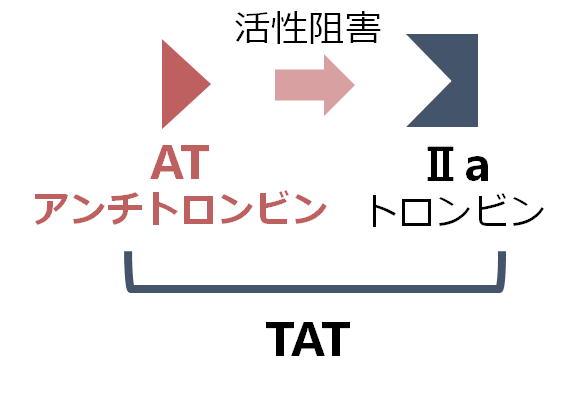
AT(antithrombin:アンチトロンビン)はⅡa(トロンビン)と結合して酵素活性を阻害します。ヘパリンはこの経路を促進することで抗凝固作用を持ちます。Ⅱa(トロンビン)は半減期が短く測定困難なので、ⅡaとATの複合体であるTAT(thrombin antirhtombin complex)で凝固因子の活性化を評価します(線溶系のPICと対応した測定項目です)。
2:TMの経路
Ⅱa(トロンビン)が血管内皮細胞のTM(thrombomodulin: トロンボモデュリン)と結合すると、プロテインCを活性化させ、活性化プロテインC(APC: activated protein C)になります。活性化プロテインCはプロテインSを補酵素としてⅤa, Ⅷaを分解することで凝固カスケードを抑制します。
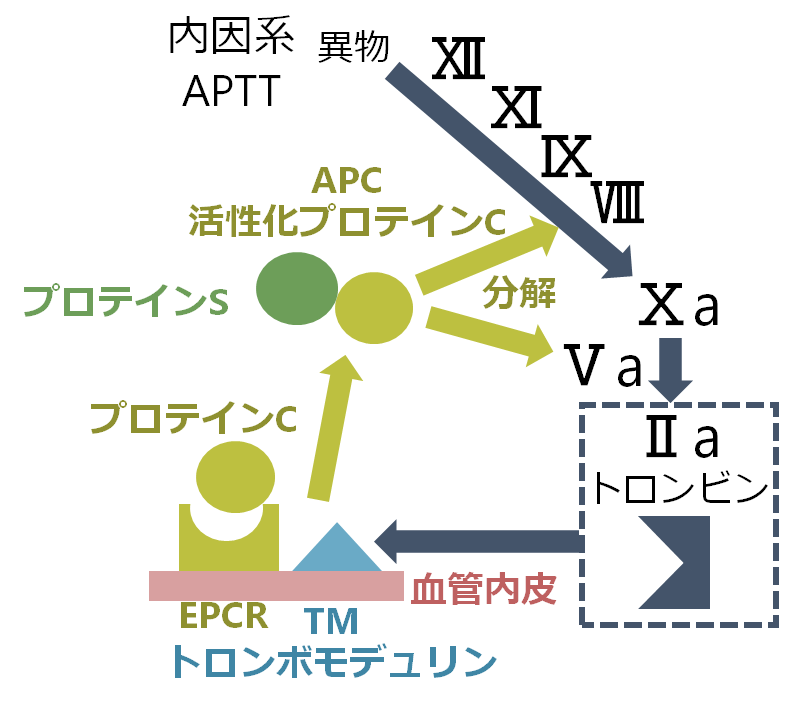
これらAT、プロテインC、プロテインSはどれも欠乏すると凝固カスケードを制御できなくなるため、体全体は血栓傾向になります(日本では先天的なⅤa欠損はない)。
2:検査の解釈
■PT単独延長
病態:外因系Ⅶ因子(肝臓で産生・半減期4~6時間)の活性化10%未満になると延長します。ビタミンK依存的に合成されます。
原因:ワーファリン、ビタミンK欠乏、肝不全
■APTT単独延長
病態:内因系の凝固因子のいずれかが活性化15~30%未満になると延長します。
原因:ヘパリン、後天性血友病、抗リン脂質抗体症候群、von Willbrand病
*参考:後天性血友病A(acquired hemophilia)
・成人発症(60歳以上の高齢者に多い),特発性もある(背景に自己免疫性疾患がなくとも)
・病態:第Ⅷ因子に対する自己抗体産生
・検査:APTTクロスミキシング法(正常血漿と患者血漿を混合→①凝固因子欠乏 or ②インヒビター存在の鑑別に用いる→抗体存在下ではAPTT延長のまま)・第Ⅷ因子活性・インヒビター測定
・原因不明のAPTT延長,高齢者の易出血性で考慮する必要がある(特に筋肉内出血など)
・治療は免疫治療とバイパス療法(第Ⅶ因子製剤補充)
■フィブリノーゲン(fibrinogen)
臨床的にフィブリノーゲンが重要なのは特に出血の場面です。出血で問題になることは、出血により凝固因子の消費、喪失、輸液などでの希釈により凝固障害をきたすという点です。ここで最も喪失しやすいのはフィブリノーゲンで、一般的に100mg/dL以下になると止血能力を失うとされています。
このためフィブリノーゲンが低くなってきた場合はFFP(fresh frozen plasma)輸血などにより凝固因子の補充が必要になります。フィブリノーゲン値はこの臨床的判断に有用です。なので、出血を疑う場合、その他凝固障害を疑う場合は必ず提出するようにします。DICでの凝固因子消費でもフィブリノーゲン値が減少するため重要です。
話がすこしそれますが、私たちはHb=”7″という数字とHb=”14″という数字でそれぞれイメージがあると思います(”7″は低いなー、”14″は普通だなーというような感じ)。しかしフィブリノーゲンに対してこの数字のイメージがあるでしょうか?普段フィブリノーゲンの値を眺めていないとこの感覚は養われないと思うので、是非フィブリノーゲンを測定する場合はフィブリノーゲン値に注目してみてください。
■FDPとD-dimer
FDPはフィブリノーゲンかフィブリン、D-dimerはフィブリンの分解産物です。血栓が産生されると線溶系により分岐されることで両者は基本的一緒に上昇します。しかし、線溶系がとても亢進している場合は、フィブリノーゲンがフィブリンになる前に線溶系により分解されてしまいます。この場合フィブリノーゲンが分解されるのでFDPは上昇するのですが、フィブリンはまだ少ないためD-dimerはあまり上昇しないというFDPとD-dimerの解離が起こります。これは特に線溶亢進型DICで特徴的です。このような理由からDICを疑う場合は基本的にFDPも提出するべきです。
■D-dimerの解釈
D-dimerはDICや深部静脈血栓症といった凝固障害だけでなく、感染症、外傷、手術後、妊娠、悪性腫瘍、慢性炎症、肝疾患、腎疾患、高齢など様々な病態で上昇することが知られています。つまりD-dimerの特徴として、血栓形成に関して感度は高いが、特異度は低いという一般的な認識が重要です。
VTE(venous thrombo-embolism: 静脈血栓塞栓症)の診断に関しては有名なWells criteriaで臨床的な検査前確率を見積り、検査前確率が低い場合にはD-dimerが陰性であれば除外可能としています。
もう一つD-dimerの診断への関与で議論になる疾患が大動脈解離です。これも臨床的に検査前確率が低い場合は、感度95%、NPV(negative predictive value):98%で除外に有用ですが、検査前確率が低くない場合は十分に除外しきれなかったと報告されています(Ann Emerg Med 2015;66:368–78.)。つまりここでもVTEと同様に臨床的な検査前確率が前提条件として重要で、D-dimer単独では解釈が難しい、診断の除外はできないということです。
重要なことはVTEにしても大動脈解離にしても臨床的な検査前確率をすっとばして、D-dimerの値だけで解釈してはいけないという点です。VTEにしても大動脈解離にしても臨床的な検査前確率が低い場合には除外に有用であるが、検査前確率が低くない場合はD-dimer陰性でも除外はできません。また値の高い低いでの議論もできません。これは感染症診療でのCRPと少し似ているように思います。CRPが10以上だから肺炎らしいとは言えないように、臨床的な文脈が圧倒的に大切だということです(肺炎を疑う下気道症状、呼吸回数などが重要ですよね)。
個人的にはD-dimerは臨床現場でやや過信されすぎているところがあり(D-dimer信仰?)、本来そのような解釈が出来ないところまで拡大されて解釈されてしまっているきらいがあるように感じています(経過でD-dimerがちょっと上がったからVTEのリスクがある、ちょっと下がったからVTEのリスクが低いといった間違った使い方)。正しい適応を勉強して、使っていくことが重要なのだと思います。
まとめ D-dimerの解釈
・血栓形成に対して感度が高いが、特異度は低い
・D-dimer値単独で判断をしない、臨床的な検査前確率とセットで解釈する
参考文献
・J Am Coll Cardiol 2017;70:2411–20 D-dimerの臨床での使い方に関するreviewで素晴らしい内容です。D-dimerの話はほぼここから参照させていただきました。
・総合内科病棟マニュアル 血液
・Hospitalist 血液