RIS(radiologically isolated syndrome)は多発性硬化症らしい白質病変を認めますが、明らかな神経学的な所見や病歴を認めず、またその他のetiologyも特定できない状態をさす表現です。頭痛やめまいの精査目的に頭部MRI検査を実施し偶発的に指摘される機会も増えてきていると思います。2009年にRISという言葉が導入されてからの変遷をまとめます。
定義
■RISの提唱(Barkhof criteria)Neurology ® 2009;72:800–805
一番初めにOkuda先生により提唱されたRISの定義になります。ここでの定義はT2WIで3mm以上の大きさ、ovoid、均一、境界明瞭な病変をBarkhof criteriaの最低4項目中3項目を満たすことを挙げています(詳細は以下に添付した内容をご参照ください)。

■MAGNIMS criteriaによるRISの定義 Mult Scler 2018;24:214
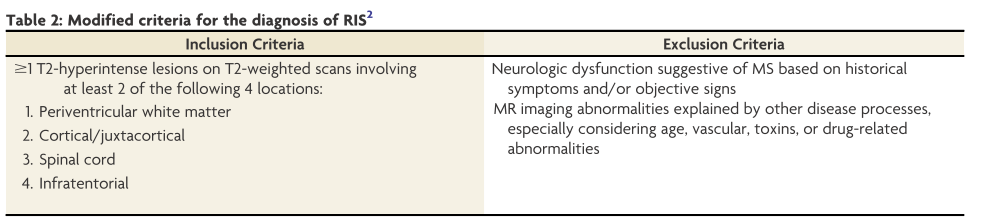
McDonald criteriaが画像所見をMAGNIMS criteriaを参照するように変遷したことから、RISの定義もMAGNIMS criteriaに沿ったものを提唱しています。具体的には、1:脳室周囲白質、2:皮質もしくは傍皮質、3:脊髄、4:テント下のうち最低2つ以上にT2WIにて病変を認めることを基準としています。こちらも参考までに詳細な内容を掲載します。
特徴的な画像所見は何か?
小静脈周囲の病変(perivenular distribution)を示唆する“central vein sign”がその他の片頭痛や虚血変化との鑑別として有用と考えられます。
■MSでの”central vein sign”に関する最初の報告(ここではperivenous lesionと表現しています) Neurology ® 2011;76:534–539
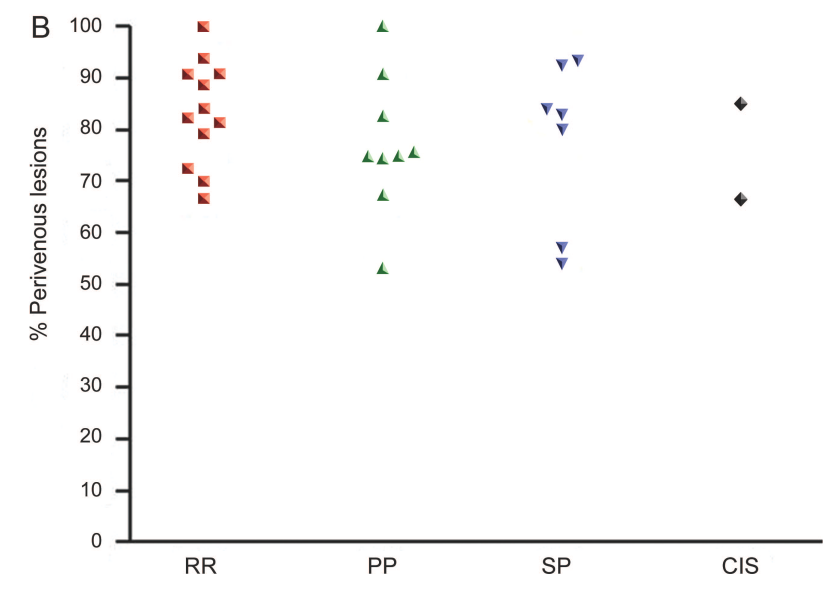
28人のMS患者(年齢中央値46.5歳(24-65歳)、罹病期間中央値14.2年、EDSS中央値5.5、病変数中央値26個)と17人のMSでない患者の白質病変に関して7T(!!)のMRIを使用し、T2*WIにて白質病変の中に血管構造が描出されるかどうかを調べた文献です(下図参照)。
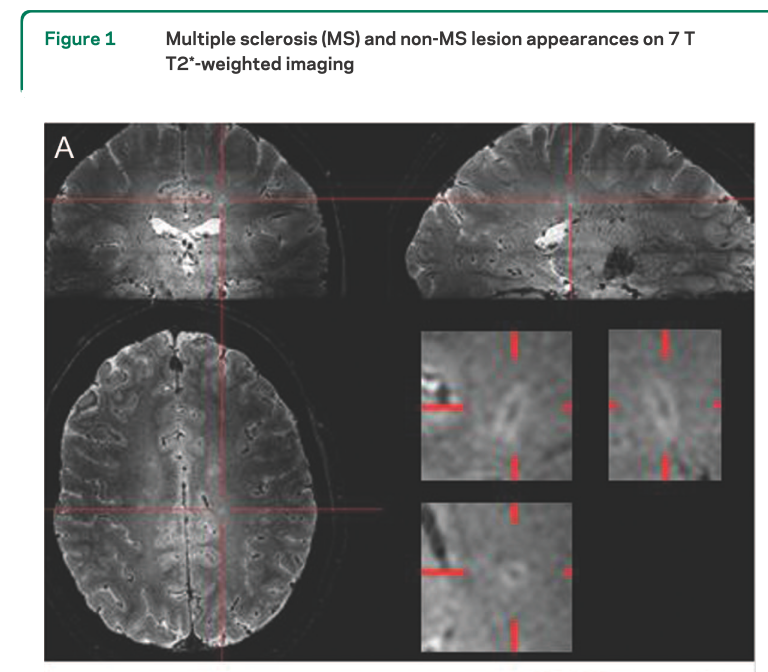
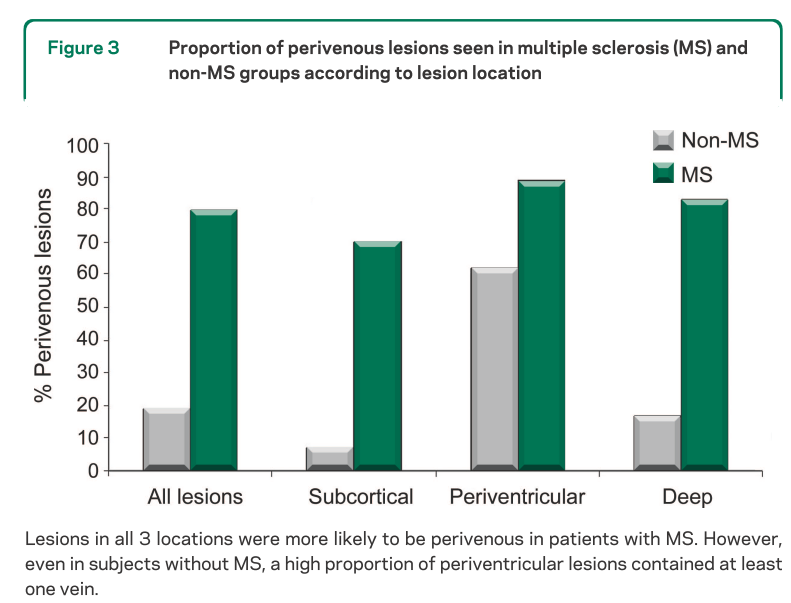
MS患者では901の病変のうち80%で同所見を認めたのに対して、非MS患者では428の病変のうち19%で同所見を認めたと報告されています。そして白質病変のうち何%が静脈構造周囲か?を考えた際に40%を基準とするとMS患者と非MS患者を区別が可能であるとしています(これを“40% rule”と称して他の論文などでは引用されています)。
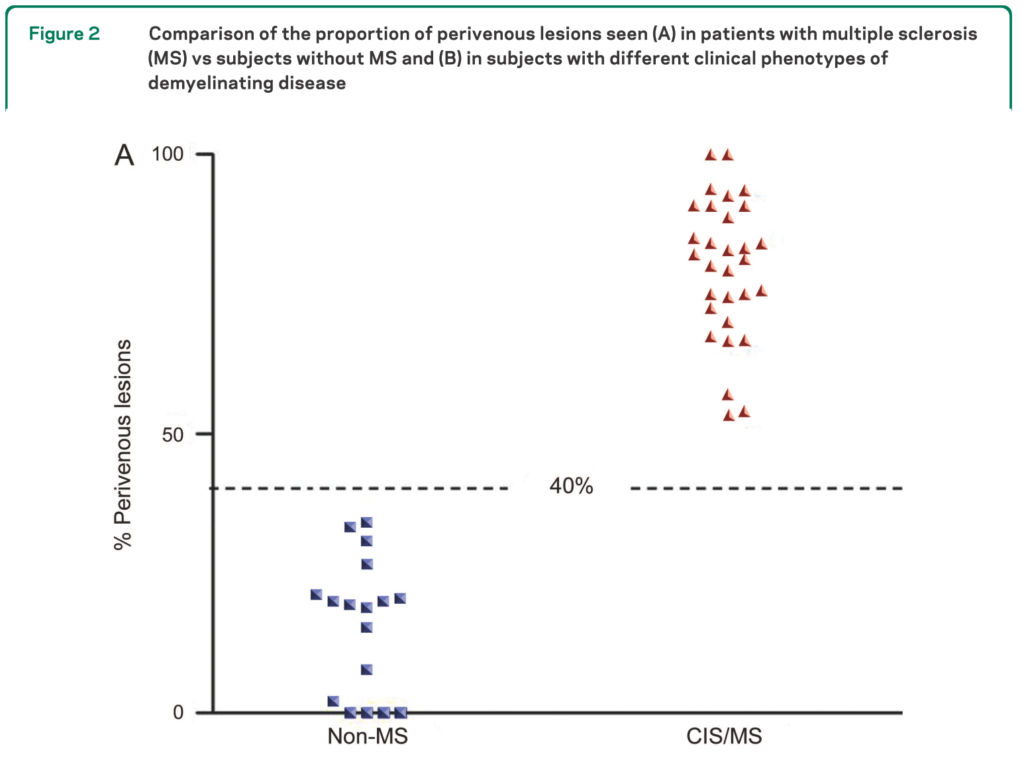
また同時に静脈周囲の病変に関して、MSの中でもPPMS, RRMS, SPMS, CISのいずれにおいても同所見を認めるとされています(下図)。
■RISでの”central vein sign”の検討 AJNR Am J Neuroradiol 40:776–83 May 2019
上記はMS患者さんでの”central vein sign”に関してですが、RIS患者さんでも”central vein sign”を認めるのか?に関して検討した文献です。RIS患者さん20例、白質病変数997を検討しており、病変の分布は皮質/傍皮質19%、深部白質56%、脳室周囲白質20%、テント下病変4%、脊髄病変は65%(13/20例)の症例で認め、Central vein signは391の白質病変のうち75%(292/391個)で認めています。この様にRIS患者でもMS患者と同様にcentral vein signを多く認めることがわかりました。
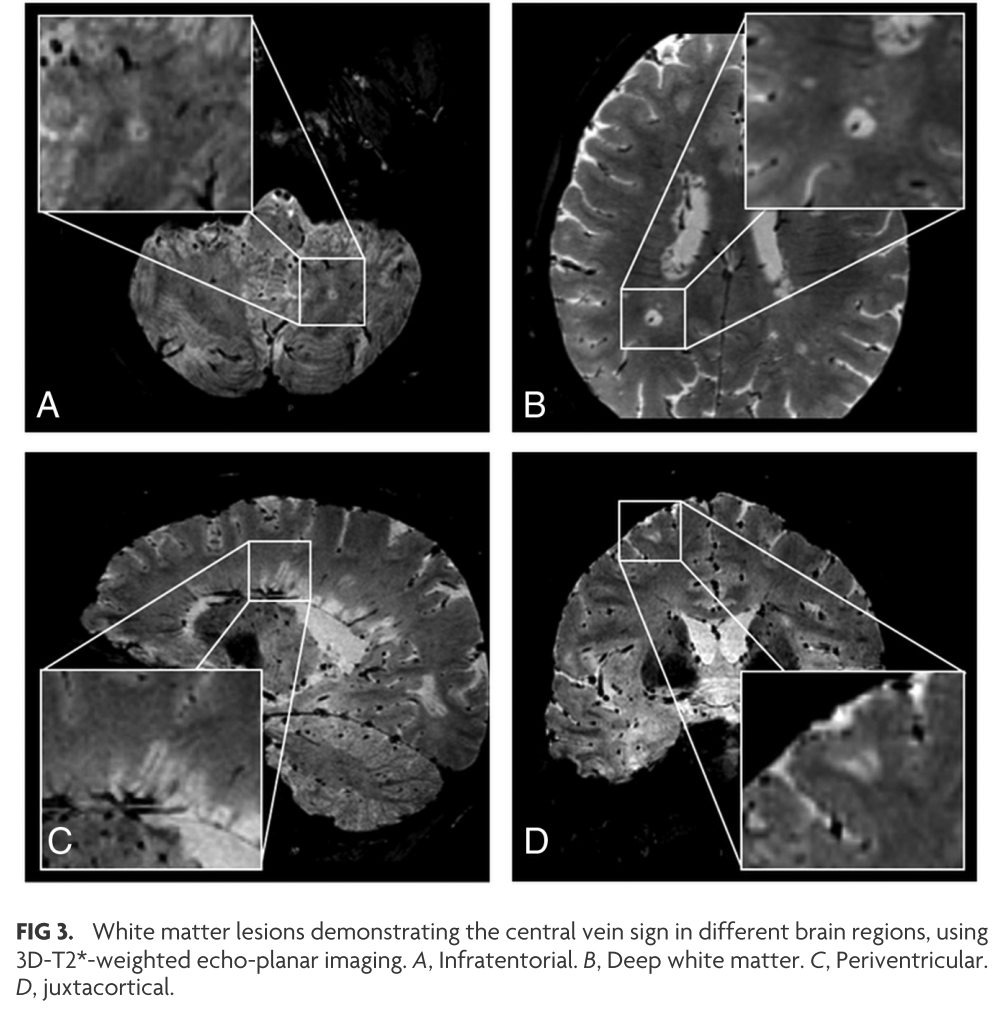
MSで用いられていた”40% rule”(前述)と”Rule of 6″(CVSを認める病変を6つ以上認める場合)が今回のコホートで当てはまるかどうかの検討は下記の通りです。

Central vein signの数と相関関係にあるものは頚髄病変数が挙げられました。

このコホートは長期に追跡していないため、今後clinical conversionするかどうか?に関してはわかりませんが、central vein signがclinical conversionのhigh riskに該当するかどうか?が今後検討されることに期待です。
RISの鑑別疾患は何か?
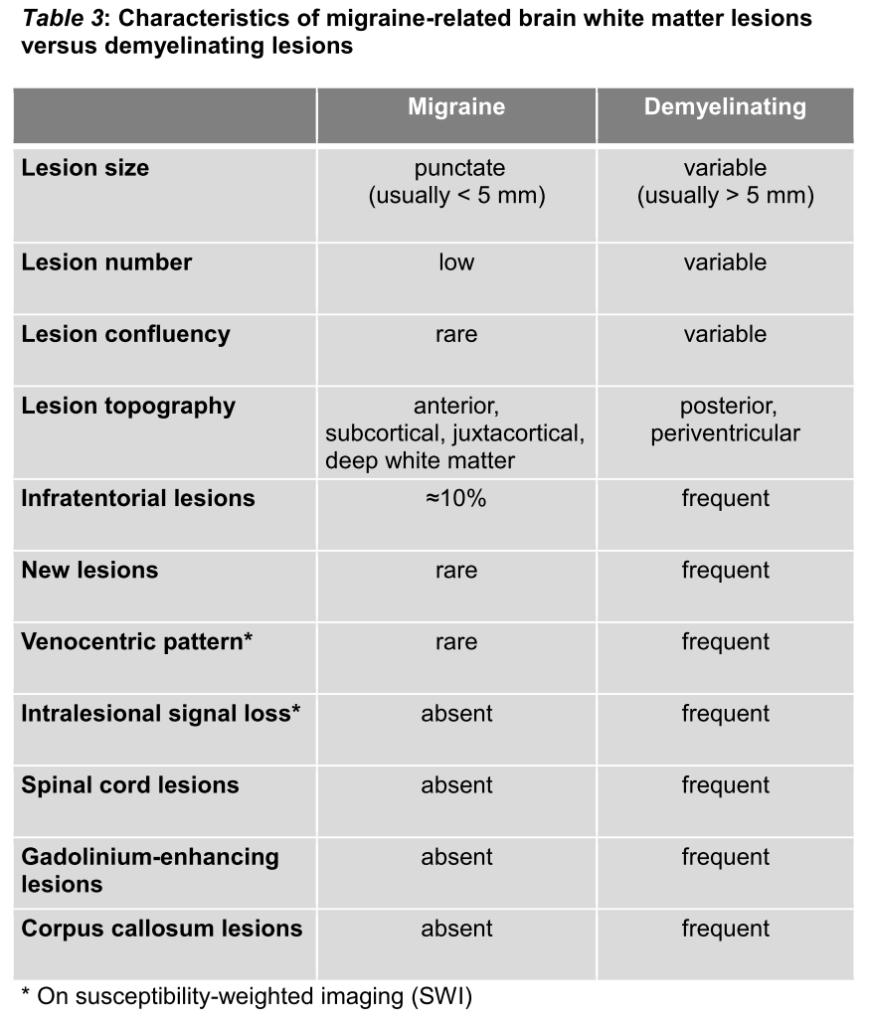
鑑別としては片頭痛、虚血性変化、CADASIL、血管炎、ADEM、外傷後変化などが挙げられ、それぞれの臨床上、画像上の特徴が下図にまとめられています。
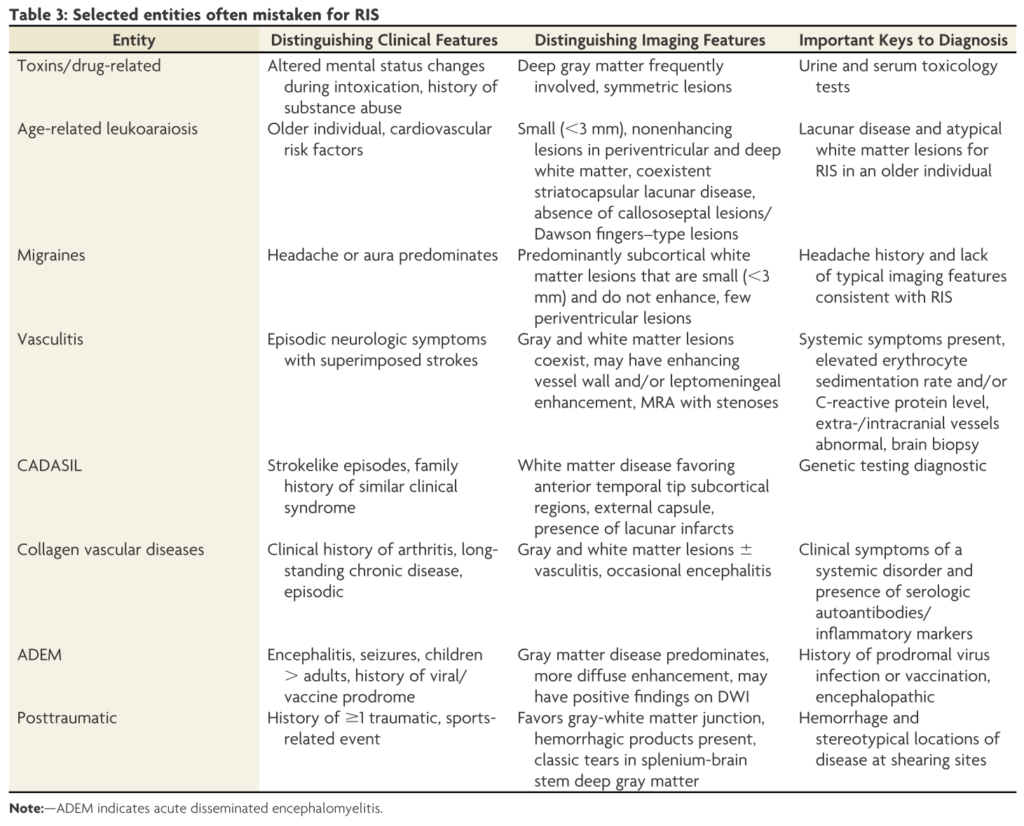
特に片頭痛はもともと多発性硬化症とも間違えられることが多い病態として知られており、画像的には下記の点に注目して鑑別をすすめます(下図はMult Scler 2018;24:214より参照)。
MSに移行するリスク因子は何が挙げられるか?
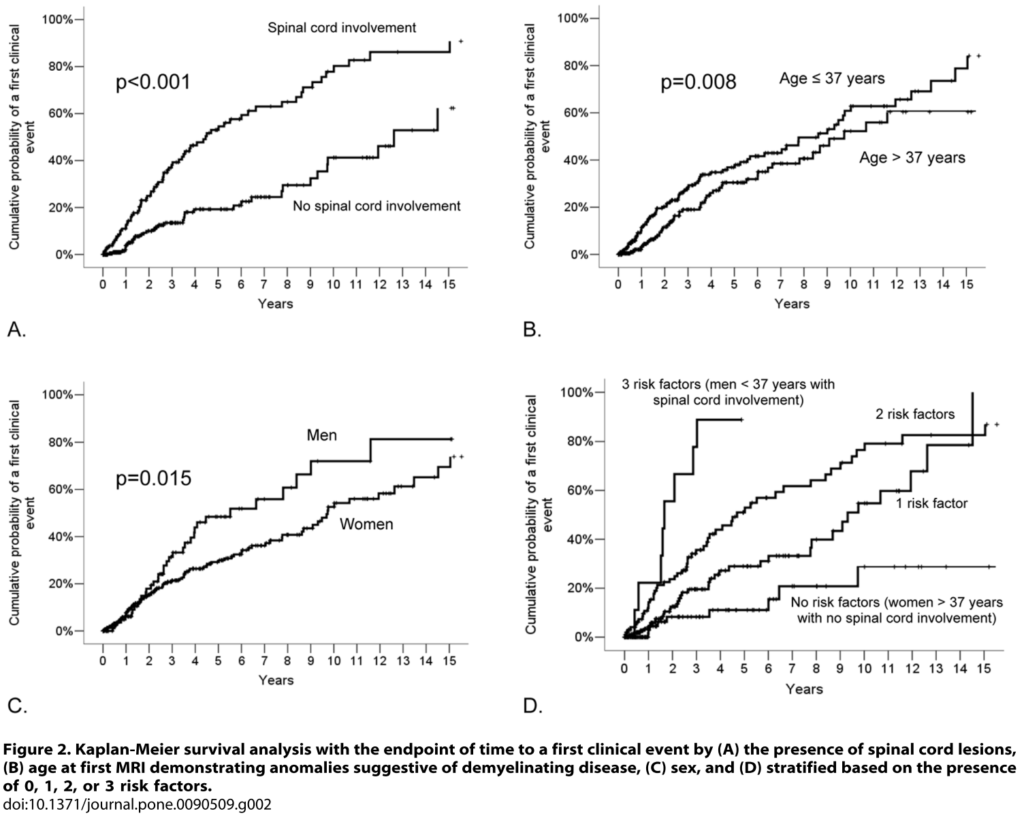
以下にRISからMSへconversionするリスク因子に関して検討した文献を掲載します。それぞれで違う点もありますが、まとめると脊髄病変、髄液OCB陽性、若年がconversionの要素として特に重要と思います。
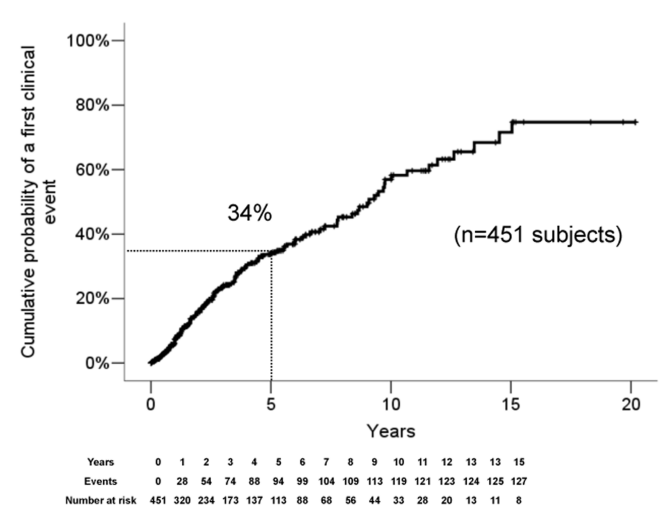
■RISのclinical conversionの予測因子451人検討 Okuda DT, Siva A, Kantarci O, Inglese M, Katz I, et al. (2014) Radiologically Isolated Syndrome: 5-Year Risk for an Initial Clinical Event. PLoS ONE 9(3):
e90509. doi:10.1371/journal.pone.0090509
5か国(22のデータベース)から451人(女性78.5%)のRIS患者を検討。患者背景は画像で初めて病変を指摘された年齢平均37.2歳(中央値37.1歳)、人種はwhite85.8%、Asian/pacific islanderは0.9%(4例)、EDSSは0が93.1%、髄液異常所見は64.7%、DMT投与は17.3%、Gd造影病変の存在28.3%、脳室周囲の病変98.7%、テント下の病変30.4%、傍皮質病変90.1%、脊髄病変35.2%、フォローアップは平均4.4年(中央値2.8年)と報告されています。5年以内のフォローアップで累計34%が臨床的な脱髄症状を呈したと報告されています。
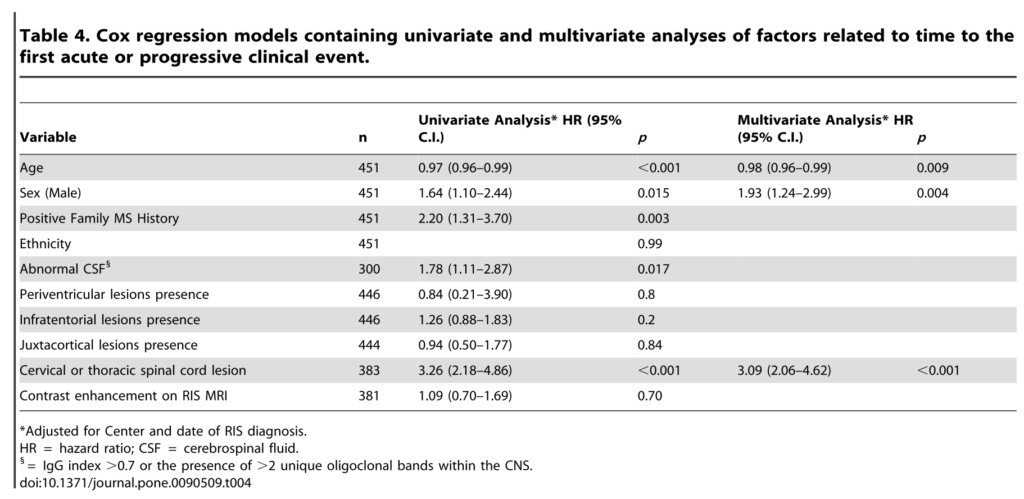
また年齢が若年(37歳以下)[hazard ratio (HR): 0.98 (95% CI: 0.96–0.99); p = 0.03]、性別が男性 [HR: 1.93(1.24–2.99); p = 0.004]、病変で頚髄もしくは胸髄病変を認める[HR: 3.08 (2.06–4.62); p = ,0.001]という3点が臨床症状発症clinical conversionの予測因子として挙げられました。ここでは髄液異常所見やGd造影病変は予測因子となりませんでした。
■上記コホートの10年フォローアップ ANN NEUROL 2020;88:407–417
上記451人のコホートのうち277人に関して(患者年齢RIS診断時:37.2歳、平均追跡期間7.2年、中央値6.7年)に関して臨床症状を呈したものがどのくらいあるか追跡でフォローした結果をまとめた報告になります。10年フォローでは51.2%がclinical event(clinical conversion to MS)を認めた結果でした(そのうちPPMSと診断されたものは12%)。
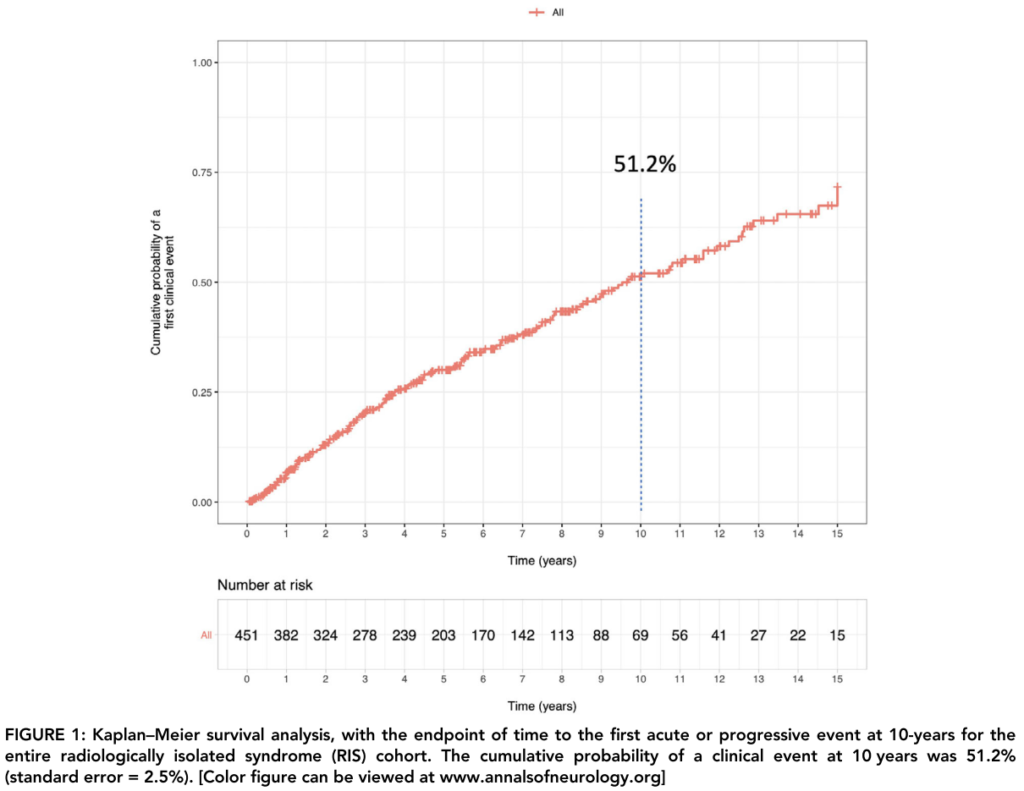
年齢が若年、髄液での異常所見(IgG index>0.7 or OCB+2本以上のバンドあり)、テント下病変、脊髄病変の4点がリスク因子として挙げられています。10年でのclinical eventはリスク因子が1つ以上で29%、2つ:54%、3つ:68%、4つ:87%とされています(下図とグラフを参照ください)。


DMTは16%で使用されていましたが、DMT使用はMS移行へのリスク因子となっていません (HR = 0.84 [95% CI: 0.53–1.33], p = 0.46)。
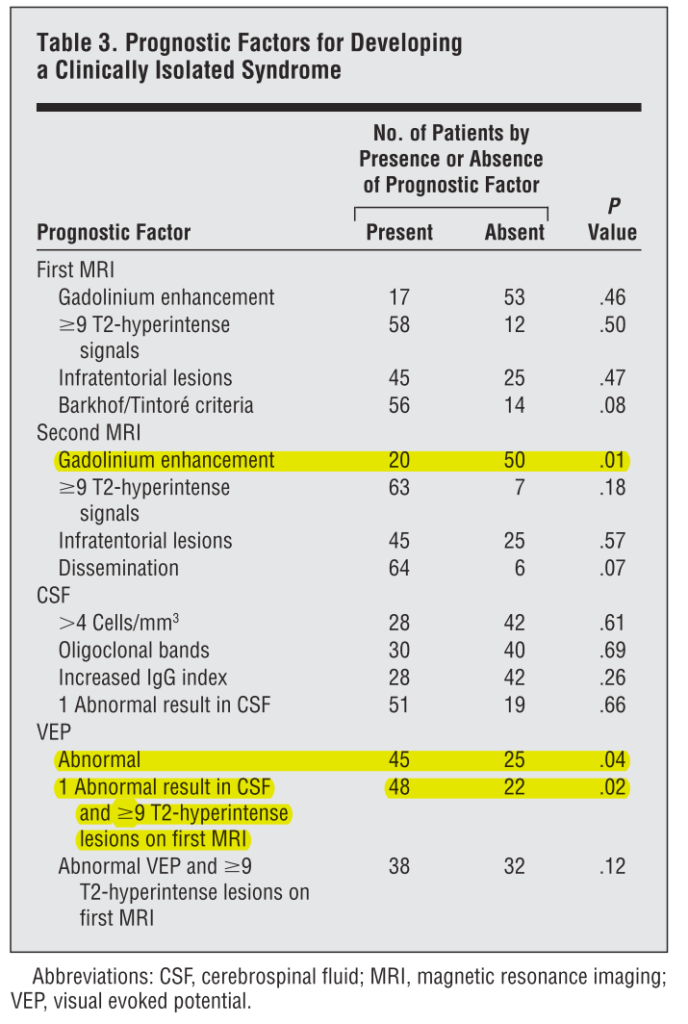
■RIS70例のフォローアップ Arch Neurol. 2009;66(7):841-846
男性17例、女性53例、平均年齢35.63歳(16-48歳)、33%(23/70例:視神経炎6例、脊髄炎6例、脳幹病変5例、感覚障害4例、小脳症状1例、認知機能障害1例)が臨床症状を呈し、最初の画像検査から臨床症状までの期間は平均2.3年(0.8-5.0年)、追跡期間は平均5.2年(3-6.4年)とされています。
このコホートでは若年、Gd造影病変、VEPでの異常所見の3点がclinical conversionの予測因子として挙げられています(下図参照)。ここでは性別、T2WI病変の数、髄液OCB、髄液IgG indexは統計的に有意な予測因子となりませんでした(これらを複数組み合わせた場合は予測因子となるものもあり下図参照)。
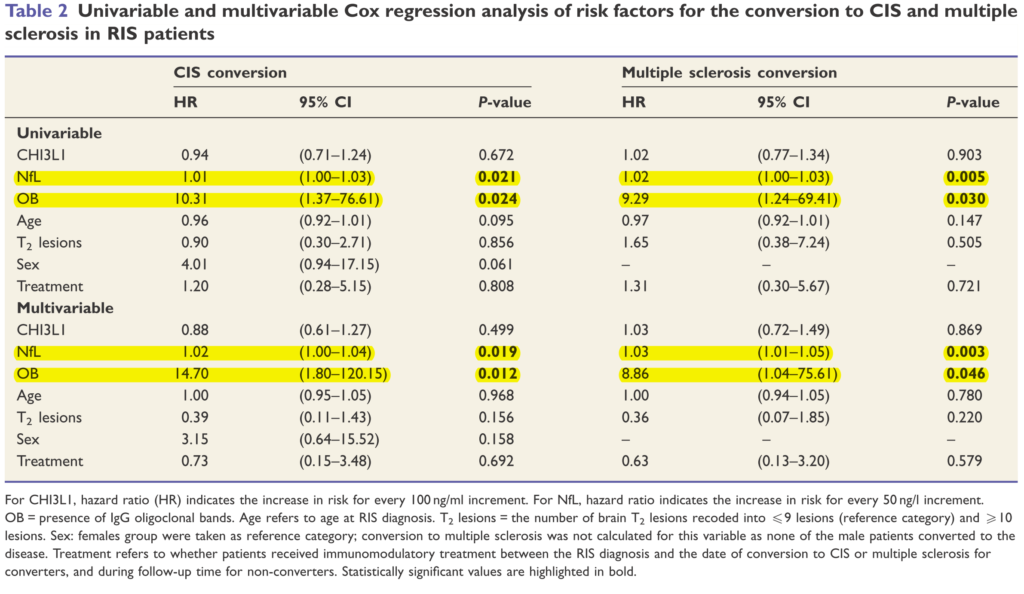
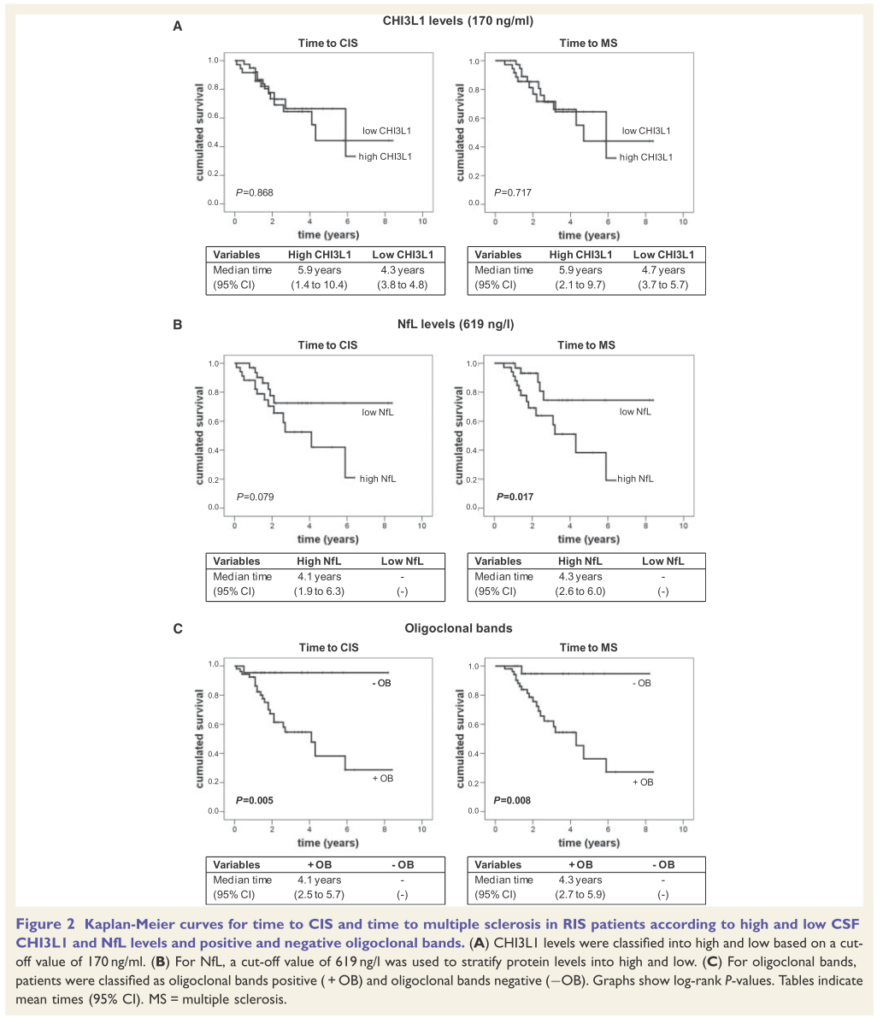
■RISからMSへのconversionを予測する髄液所見 BRAIN 2018: 141; 1085–1093
75例のRISを検討しフォローアップ期間は平均2.8年、30.7%(23/75例)が平均1.8年CISへとconversionを認めています(うち21例:91.3%はその後2010年McDonald criteriaでMSの診断)。CISとMSへのconversionを予測する因子として、Nfl(neurofilament light chain)はRIS→CIS(hazard ratio = 1.02, P = 0.019)、RIS→MS(hazard ratio = 1.03, P = 0.003)、 OCBはRIS→CIS(hazard ratio = 14.7, P = 0.012)、RIS→MS(hazard ratio = 8.9, P = 0.046)と予測因子として挙げられています。この結果からはやはりRIS患者できちんと髄液検査所見を確認するべきと考えられます。
RISの時点から治療介入をするべきなのか?
実臨床で最も悩む点ですが、この点に関してはまだ結論が出ていません。reviewでは新規の活動性病変を有する場合(Gd造影効果を持つ場合)は多くの神経内科医は治療導入を検討すると記載がありますが、いずれにせよ今後の臨床研究の結果が待たれます。
この疑問に答えるRCTが2つ現在進行中の様で結果が待たれます。
・Multi-center, randomized, double-blinded assessment of teriflunomide in extending the time to a first clinical event in radiologically isolated syndrome (RIS) (TERIS study). [April 19, 2019]
・Multi-center, randomized, double-blinded assessment of Tecfidera® in extending the time to a first attack in radiologically isolated syndrome (RIS) (ARISE) [April 19, 2019].
■expertによるconsensus opinion “Consensus opinion of US neurologists on practice patterns in RIS, CIS, and RRMS Evolution of treatment practices” Neurol Clin Pract 2016;6:329–338
論文というよりRIS、CIS、RRMSに関して神経内科医にアンケート形式でどうするか?をまとめたものになり、ここではRISに関するもののみをまとめます。回答者の75%以上の回答が一致した項目は2つ以上のGd造影病変を認める場合は治療開始する(80%)、診断のために脊髄MRI検査を実施する(94%)などとなっています。

参考文献
・AJNR Am J Neuroradiol 41:1542 – 49 Sep 2020 RISに関する最新のreviewで、非常によくまとまっておりまずRISに関して読むならこの論文と思います。
・Curr Treat Options Neurol (2020) 22: 3