色々な菌による菌血症がありますが、1番臨床上重要なのは黄色ブドウ球菌による菌血症です(SAB:Staphylococcus aureus bacteremiaという名前が付いているくらいです)。死亡率は10~20%と報告されており、感染性心内膜炎合併もあるため早期に認識して介入することが重要です。
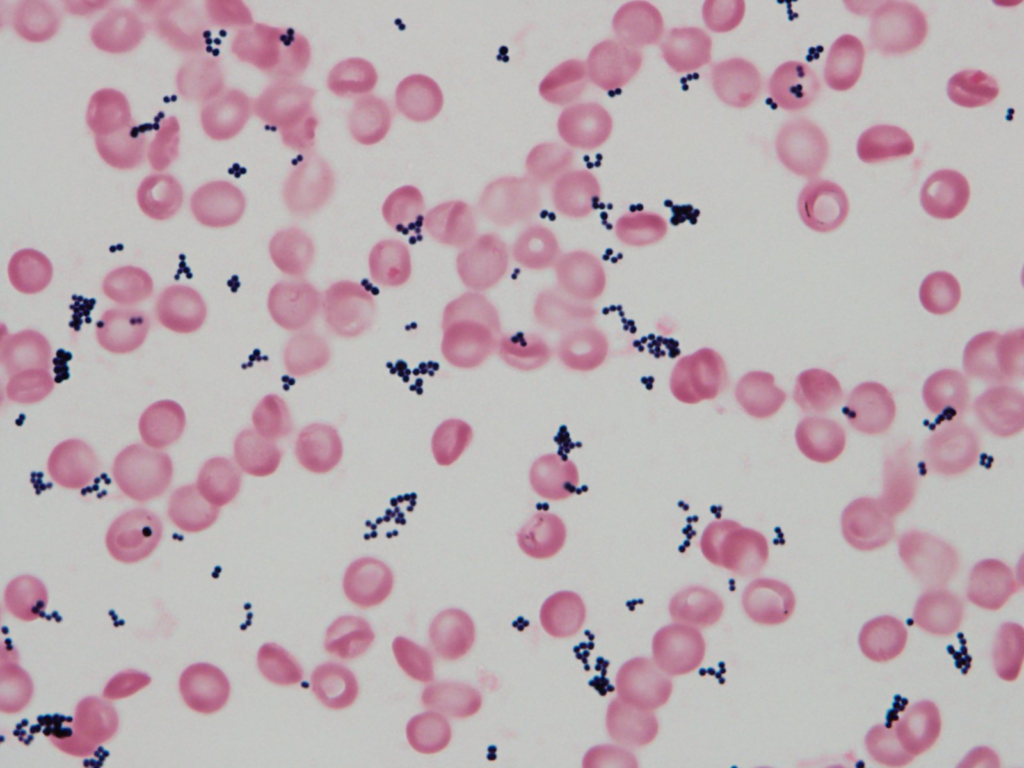
S.aureusは血液培養で1本でも検出されれば真の菌血症として扱うべきです(contamination 1.5%と報告されています)。血液培養ではまず細菌検査室から「GPC陽性です」と連絡が来ると思います(以下はS.aureus菌血症での血液培養グラム染色)。ここで必ず“GPC cluster”か“GPC chain”かを確認し、”GPC cluster”の場合は「SABが否定できるまではSABとして対応」します。GPCに関してはこちらもご参照ください。
S.aureus菌血症では以下の5点に準拠することが重要です(SAB bundle)。

以下でそれぞれに関してまとめます。
1:血液培養フォロー
血液培養でフォローが必要な菌はS.aureusとCandidaの2種類です(血液培養の基本に関してはこちらをご参照ください)。必ず初回から48~72時間後に血液培養のフォローで血液培養陰性化を確認することが必要です。感染性心内膜炎の診断では血液培養を3セット取りますが、フォローは2セットで十分です(3セットは必要ありません)。血液培養の陽性が持続する場合は血管内感染症(感染性心内膜炎を含む)や、膿瘍などの感染源ソースコントロールが不十分であることを示唆します。
2:感染源の同定+除去
感染源としては感染性心内膜炎、カテーテル関連血流感染症、皮膚軟部組織感染症、骨関節感染症(化膿性脊椎炎を含む)、肺炎(喀痰のみからのS.aureusはcontaminationの可能性がありますが、血液培養+喀痰から検出の場合は肺炎の可能性あり)などが挙げられます。これらの検索をしても、25%で感染源の同定が出来ないとされています。
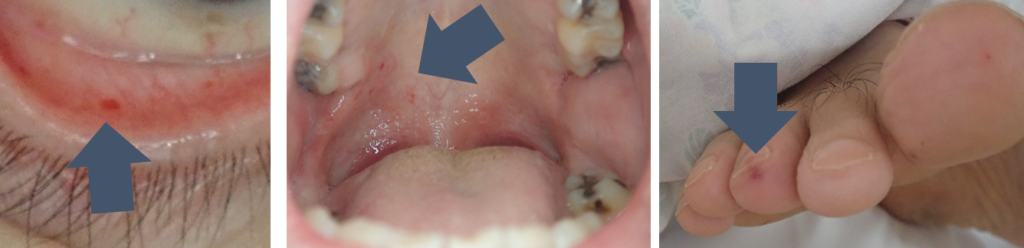
感染性心内膜炎の塞栓の身体所見を連日ないかどうか探しに行くことも極めて重要です。入院初日ははっきりしない所見が、入院後から顕在化してくることはよくあります。以下は感染性心内膜炎の自験例での身体所見(左から眼瞼結膜点状出血・軟口蓋点状出血・足指先のJaneway lesion)です。
3:感染性心内膜炎の評価 心エコー
例え感染性心内膜炎による塞栓症状や心不全徴候などを認めなくても全例感染性心内膜炎の評価は必要です。具体的には経胸壁心エコー(TTE: transthoracic echocardiography)、経食道心エコー(TEE: transesophageal echocardiography)を検討します。全例TTEは実施します。
次に問題となるのはいつTEEが必要か?という点です。どのような場合にTEEが必要か?必要ではないか?という研究は調べると色々あるようです。私はTEEを自分で行うので、ここはあえて自分の経験から個人的な意見を述べたいと思います。
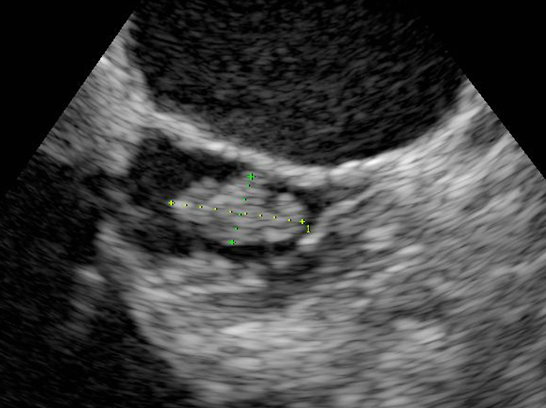
・人工弁感染、リード感染はTTEでの診断はまず無理
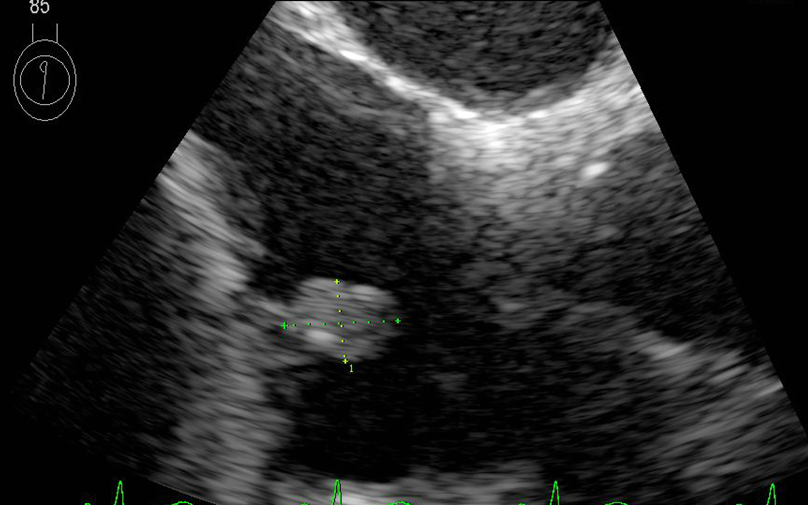
これらはアーチファクトの問題でTTEでの診断はまず不可能で、TEEが原則必要と考えた方が良いです。おそらく人工弁感染やリード感染疑いでTEEを依頼して断られることはまずないと思います(以下はペースメーカーリード感染でのTEEでの疣贅自験例です)。
・TTE、TEEの感度、特異度の問題だけで議論をしてはいけない(それぞれの症例でのTTE所見からTEEが必要かどうかを考えるべき)
日本人は比較的やせ型、かつTTEも今機械によってはかなり綺麗に左心系を描出することが出来ます。このため、TTEでも十分に僧房弁、大動脈を評価できる場合があり、そのような明らかにTTEで十分に評価しきれる場合があるにもかかわらず、そのようなTTEで十分な場合でも「感度が70%なのでTEEお願いします」というのはナンセンスです。
つまり、感度、特異度というのはあくまですべての症例をかき集めてたたき出した数字であって、それぞれの症例の個別性を尊重するべきです。つまり、TEEをする場合も、「TTEでのこの部分が気になったからTEEを行う」という議論が本来は行われるべきです。これは私は自分でTEEをするようになってはじめて学んだことです。
*参考:感染性心内膜炎らしさの評価 “VIRSTA” J Infect 2016;72:544-53
・中枢または末梢の塞栓症 5点
・髄膜炎 5点
・永続留置心内デバイスまたはIEの既往 4点
・静脈薬物使用者 4点
・自然弁疾患の既往 3点
・持続性菌血症 3点
・骨髄炎 2点
・市中または非医療関連発症 2点
・重度敗血症またはショック 1点
・CRP>19 mg/dL 1点
感染性心内膜炎合併
2点以下:感度95.8%, 特異度44.2%
→経食道心エコーを実施するかどうかの参考基準に
4:適切な抗菌薬選択
・MSSAの場合:第1世代セフェム系 セファゾリン(CEZ)
・MRSAの場合:バンコマイシン(VCM)
・アミノグリコシド系・リファンピシンの併用:推奨しない
MSSAの場合、日本での第1選択は第1世代セフェム系のセファゾリン(CEZ)です(海外ではMSSA用のnafcillin, oxacillinがありますが、日本にはないため)。セフェム系の注意点としてはセフタジジム(CAZ)では治療失敗例の症例報告があるため、使用するべきではないとされています。セフトリアキソン(CTRX)やセフォタキシム(CTX)がCEZと同様に有効かどうかはまだ十分なデータがありません。またMSSAの治療としてVCMは治療成績がCEZと比べて悪い後ろ向き研究の報告があるため基本的には使用しません。
MRSAの場合、まずはバンコマイシンでの治療を開始し、trough値は15~20程度の高めに設定します。
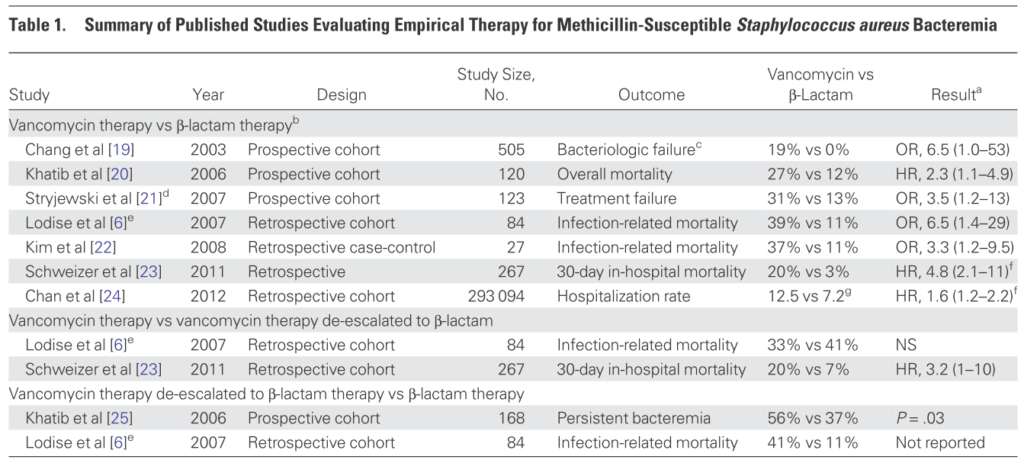
培養結果でまだMSSAかMRSAか分からない場合はVCM+CEZから開始し、結果が分かり次第de-escalationします。培養結果が分からない場合に、VCM+CEZのcombination therapyとするか?VCM単独で開始するか?に関してはVCM+CEZのcombination therapyを現状は推奨します(培養結果判明し次第de-escaaltion)。MSSA菌血症に対してVCM単剤で開始し、β-lactamへde-escalationしただけでも、最初からβ-lactamを使用しているよりも予後が悪いことが指摘されています。先ほど述べたようにMSSAに対してVCMはβ-lactamと比較して治療成績が悪いため、現状は前向きに両者を比較した研究はないですがVCM+CEZを当初は使用するべきと考えます(CID 2013;57:1760 以下の臨床研究結果のまとめもこの論文から引用しています)。
アミノグリコシド系との併用でのシナジー効果は古くから”in vitro”で指摘されていますが、臨床試験では併用により予後を改善したデータはなく、腎機能障害のデメリットが臨床的なメリットを上回るとされています。このためアミノグリコシド系の併用は感染性心内膜炎の合併有無を問わず推奨されません。
リファンピシンの併用も効果を指摘されていますが、現時点ではルーチンでの併用は推奨されていません(ARREST試験:SAB患者758人を無作為にRFP併用群とプラセボ群に割り付け、12週間後の治療失敗に関して有意差なし Lancet 2018;391: 668)。
■中枢神経感染合併の場合
難しいのがS.aureusによる(特に感染性心内膜炎)中枢神経合併症(脳膿瘍、微小動脈瘤による脳出血)を併発している場合です。海外では中枢神経移行性のあるnafcillin, oxacillinがあるため問題ないですが、日本ではこれがない点です。第1世代セフェム系のセファゾリンは中枢移行性はないため、代替薬が必要です。適切なものがないため、第3世代セフェム系(セフトリアキソン・セフォタキシム)、第4世代セフェム系(セフェピム)、ビクシリンS(採用していない施設もあり)、カルバペネム系にするといった方法があります。この選択は施設ごとによると思います。
難しいのが中枢神経合併が臨床的には分からない場合がある点です。つまり必ずしも神経学的巣症状を伴わずにひっそりと膿瘍形成をしている場合をたびたび経験する。こうすると、最初の評価の時点で中枢神経症状がないからといってずっと第1世代セフェム系で治療を継続していてよいのか?という問題があります。ではどうすれば良いか?答えは正直ありません。私のやり方はSABの治療中、無症状であったとしてもMRIを必ず1回は撮影するようにして、脳膿瘍合併や微小動脈瘤由来の微小出血がないかどうかを確認しています。
5:適切な治療期間の設定
・非複雑性菌血症:10~14日間
・複雑性菌血症:4~6週間 *感染性心内膜炎、人工物あり、持続菌血症、他臓器の感染所見など
ここでも血液培養の陰性をきちんと確認することが重要です。より短期の治療期間で問題ないかどうか?もしくは経口薬への切り替えが可能かどうか?に関しては十分な情報が現状ありません。SABのreviewでは(Lancet Infect Dis 2011;11: 208)、SABに関して今までRCTに組み込まれたのが1500例以下であり、根拠ある治療薬の選択、治療期間の設定などのデータに乏しいことを問題点として指摘しています。
以上黄色ブドウ球菌菌血症(SAB)に関してまとめました。内科医はSABに関してそのマネジメントに十分習熟しておくべきと思いますので、参考になりましたら幸いです。
参考文献
・Lancet Infect Dis 2011;11: 208
・Sanford guide