病態
後天的な自己免疫の機序により末梢神経の特に髄鞘が障害されることがCIDPの機序です。自己抗体が攻撃をしやすい部位(脱髄が起こりやすい部位)はBNB(blood nerve barrier)が生理的に脆弱な神経根部、神経最遠位部に起こりやすいとされています。
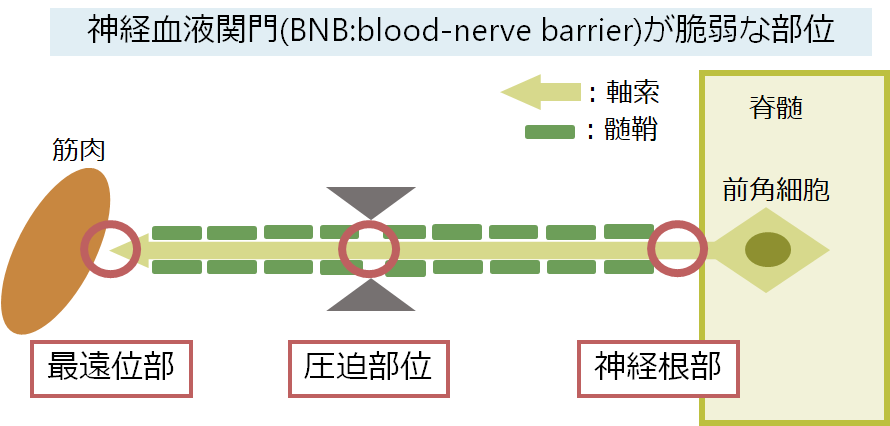
これはつまり、障害が神経の長さに依存しない(non-length dependent)ということを意味しており、長さが短い神経(近位筋を支配)、長さが長い神経(遠位筋を支配)どちらも障害されることを意味しています。これを反映して名称は”polyradiculoneuropathy”となっており、神経根の問題であることが強調されています。臨床経過は慢性進行性の経過をとる場合や再発寛解の経過をとる場合があります。
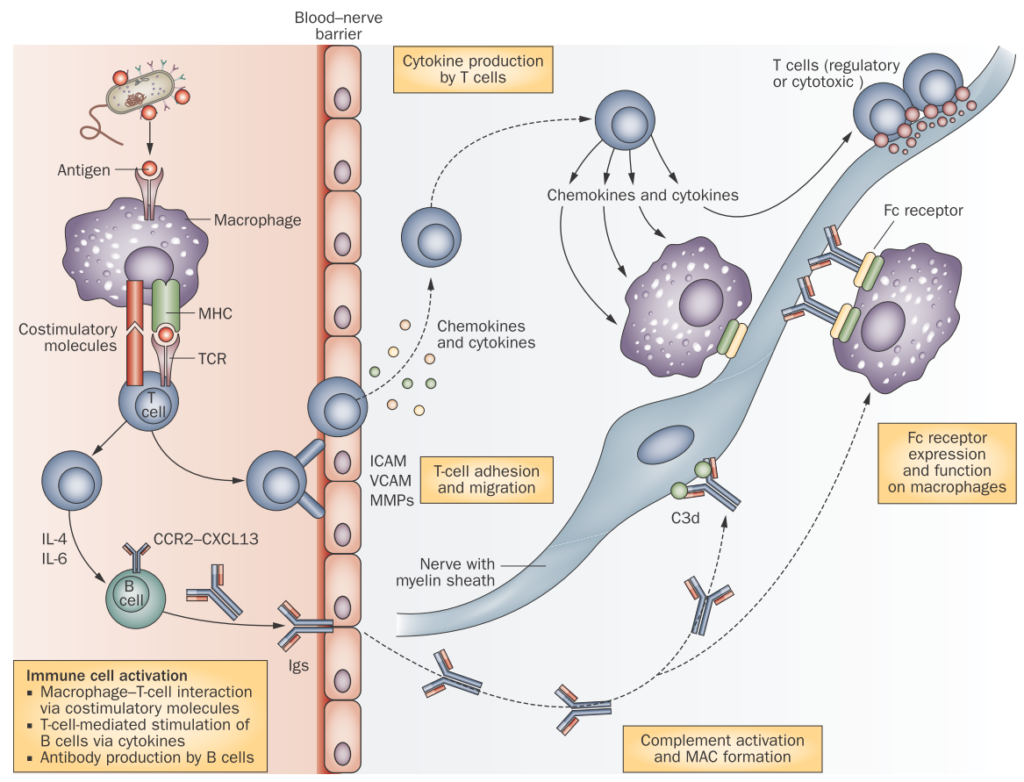
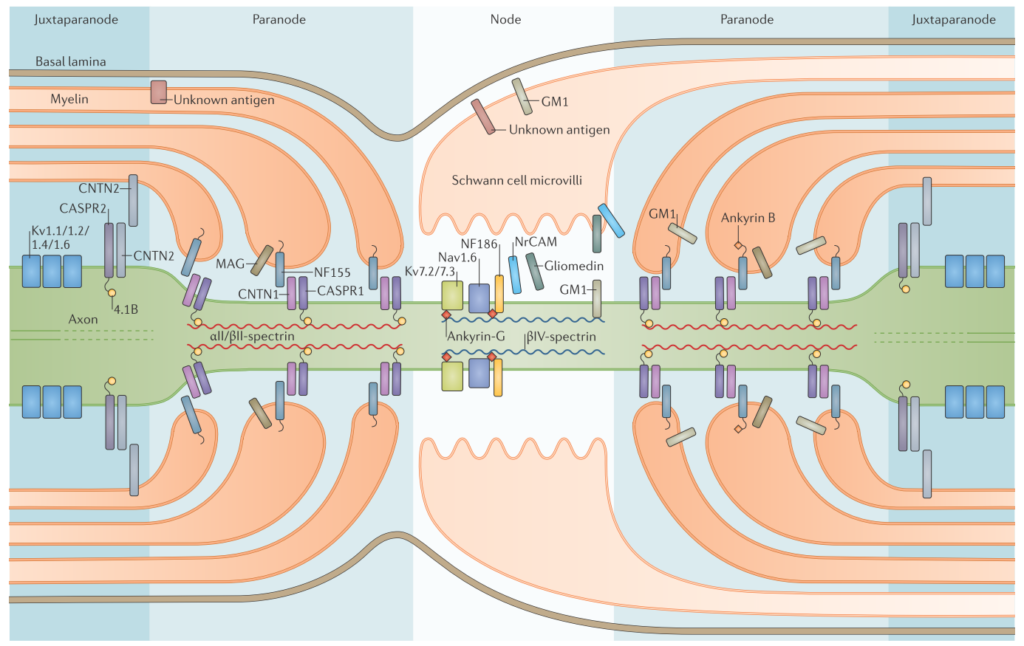
CIDPに特異的な自己抗体はもともと指摘されていませんでしたが、近年ランビエ絞輪周囲に対する自己抗体が多く同定されるようになり、自己抗体と障害部位、そして臨床像の対応関係がだんだんと解明されるようになってきました。一般的にnode, paranode, juxtaparanodeと分類されます。
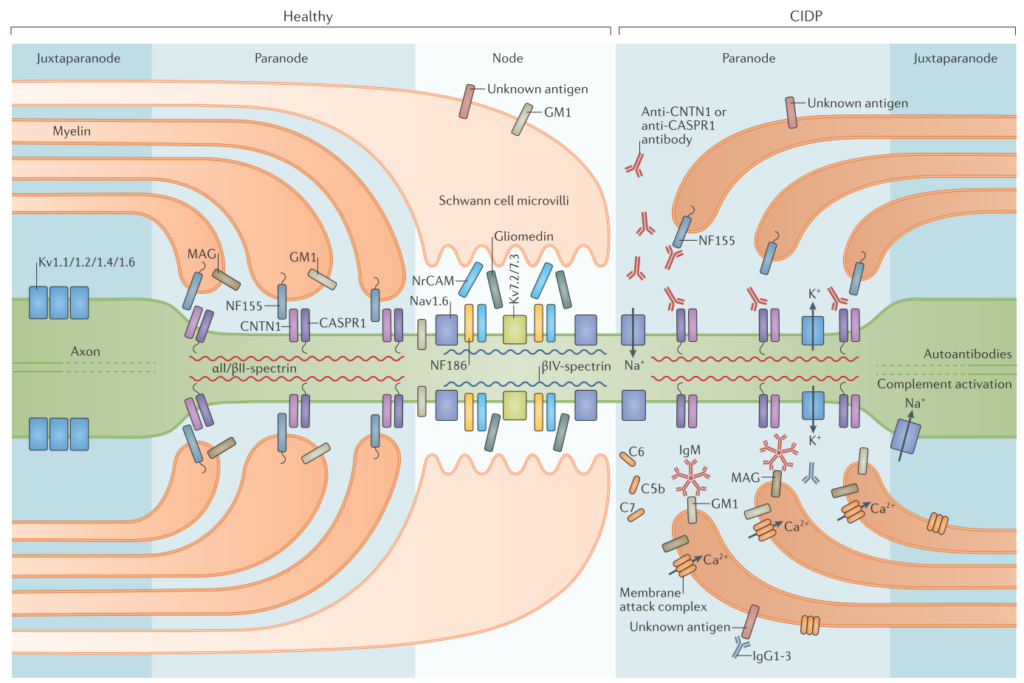
CIDP患者さんではこの部分が自己抗体の免疫反応により障害を受けます(下図右側)。
分類
ひと言でCIDPと言ってもその範囲は非常に広く、heterogeneousな疾患です。以下にまとめを載せます。
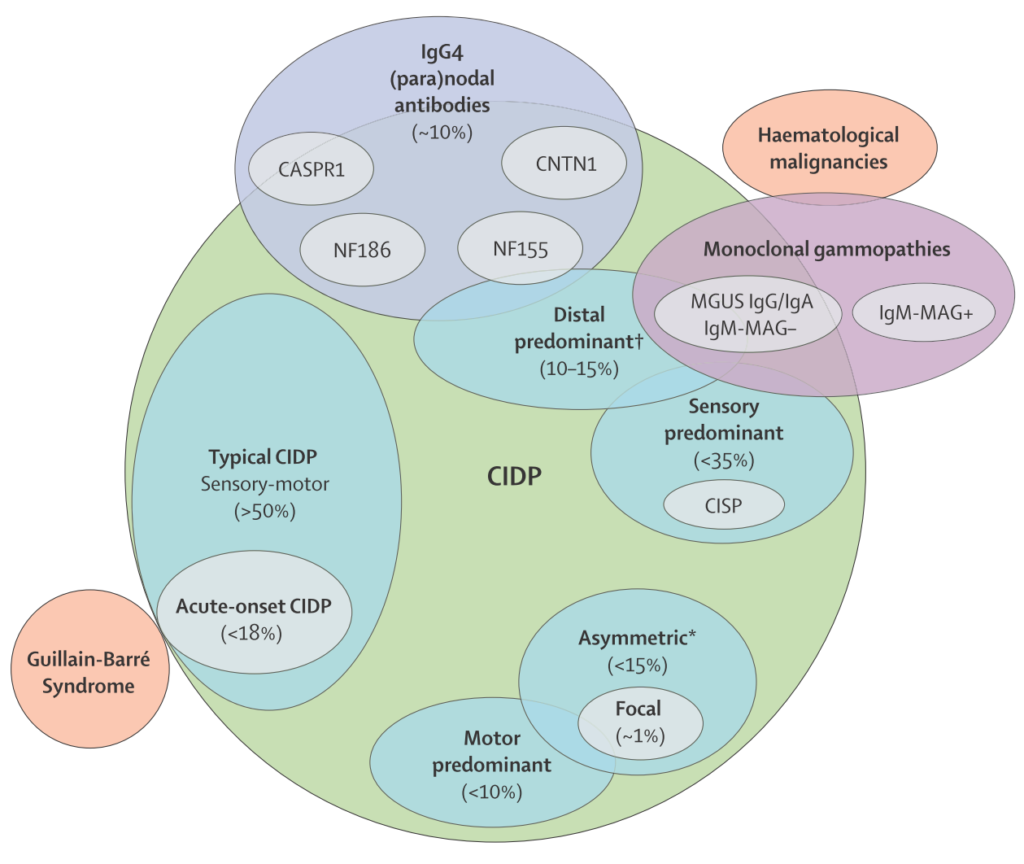
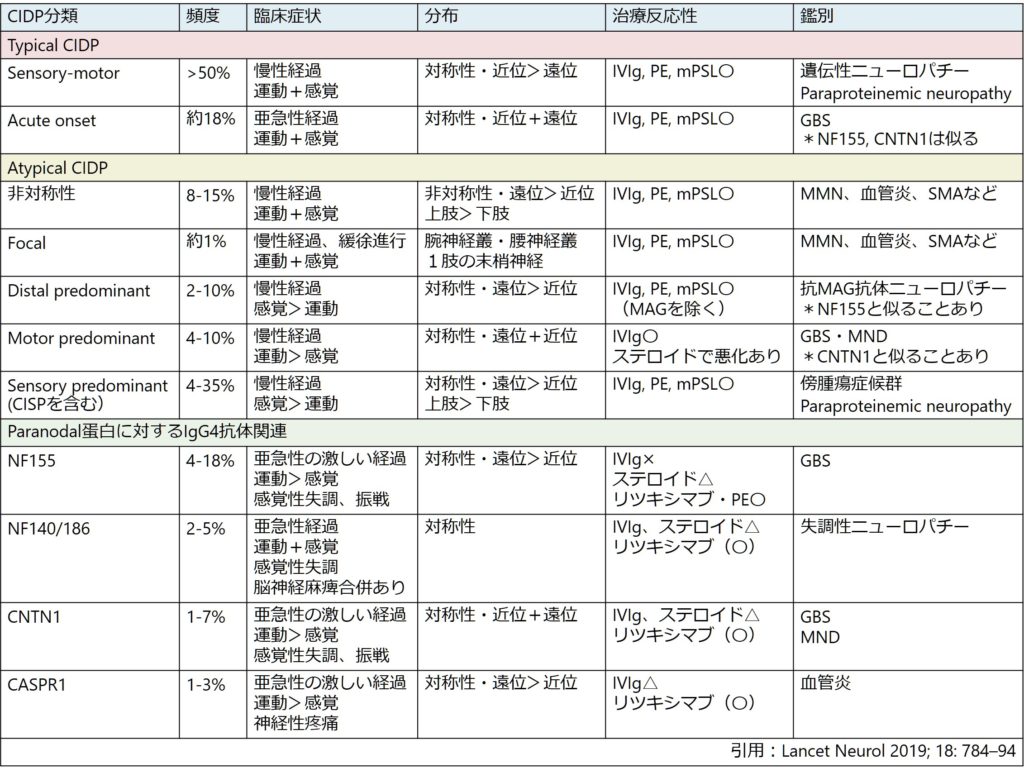
症状
運動症状に関してはtypical CIDPでは病態のところでも解説しましたが、神経の長さ非依存的の障害をきたす(non-length dependent)ため近位筋、遠位筋どちらも障害されることが特徴です。特にその他の脱髄疾患は一般的に遠位筋から障害されることが多いため、近位筋障害が主体の場合はtypical CIDPを支持する所見となります。
ポイント:末梢神経障害で初期から近位・遠位筋どちらも障害する疾患は”AIDP” or “CIDP”
CIDP誤診のreviewでは確かにCIDPで疲労、疼痛、自律神経障害を合併することはありますが、自律神経障害、疼痛、疲労などが主症状になる場合は診断を再考したほうが良いとされています(自律神経障害主体は特にアミロイドーシス、疼痛主体は特に血管炎性ニューロパチー)。CIDPの症状としても良いとくくってしまうと何でもありになってしまいますが、CIDPとして典型像に沿っているのか?という視点で診断していく姿勢が求められます。
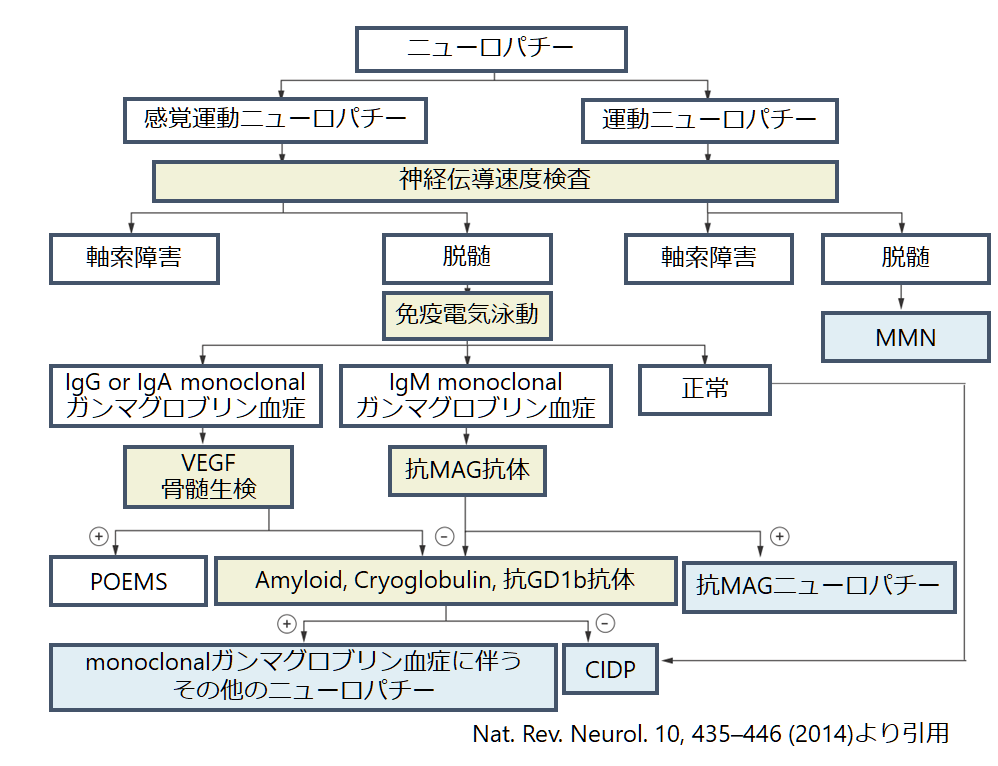
後天性慢性脱髄性ニューロパチーの鑑別
軸索障害によるニューロパチーと比べて脱髄性のニューロパチーはその鑑別がかなり限られます。後天性の慢性脱髄性ニューロパチーの鑑別は下記のアルゴリズムが提唱されています。
遺伝性ニューロパチーとの鑑別
多くの場合は後天性の脱髄性ニューロパチーの鑑別としてCIDPが挙がりますが、遺伝性ニューロパチーとの鑑別が問題になる場合がりその代表格がCharcot Marie Tooth病です。以下にCIDPとCMTの鑑別点をまとめます。経過ももちろんですが神経伝導速度検査では、CMTは全体的に均一に障害を受けることを反映して全体的な伝導速度低下を認めるのに対して、CIDPは部分的に障害されるため左右差や同じ神経内でも局所的に伝導ブロックを認めることがある点が鑑別点として重要です。

診断基準
CIDPは誤診が非常に多いことが有名です(実はCIDPでない疾患をCIDPと診断してしまう)。CIDPと当初診断されていたが実は違った診断であったということをは多いと思います。ゴミ箱診断的に後天性慢性脱髄性疾患がCIDPとなってしまうことを避けるべく、まずはきちんと診断基準と照らし合わせて矛盾点がないかどうかを確認する作業が重要です。以下に臨床的診断基準と電気診断基準を日本のガイドラインからそのまま引用させていただきます。

電気診断基準(以下) CIDPの誤診理由としては神経伝導速度検査のtechnicalな問題(最大上刺激になっていないため見かけ上伝導ブロックにみえてしまうなど)や検査結果解釈の問題が大きいため注意です。

CIDPと誤診
CIDPの誤診に関してまとめたreview(Neurol Ther (2020) 9:43–54)では、1:atypical CIDPで誤診が特に多い、2:神経伝導検査の実施・解釈、3:髄液蛋白の0.45~0.60mg/dLを上昇としてよいか?、4:治療反応性をきちんと客観的指標によらず主観的な指標にしてしまっているという4点を特に誤診で注するべき点として挙げています。
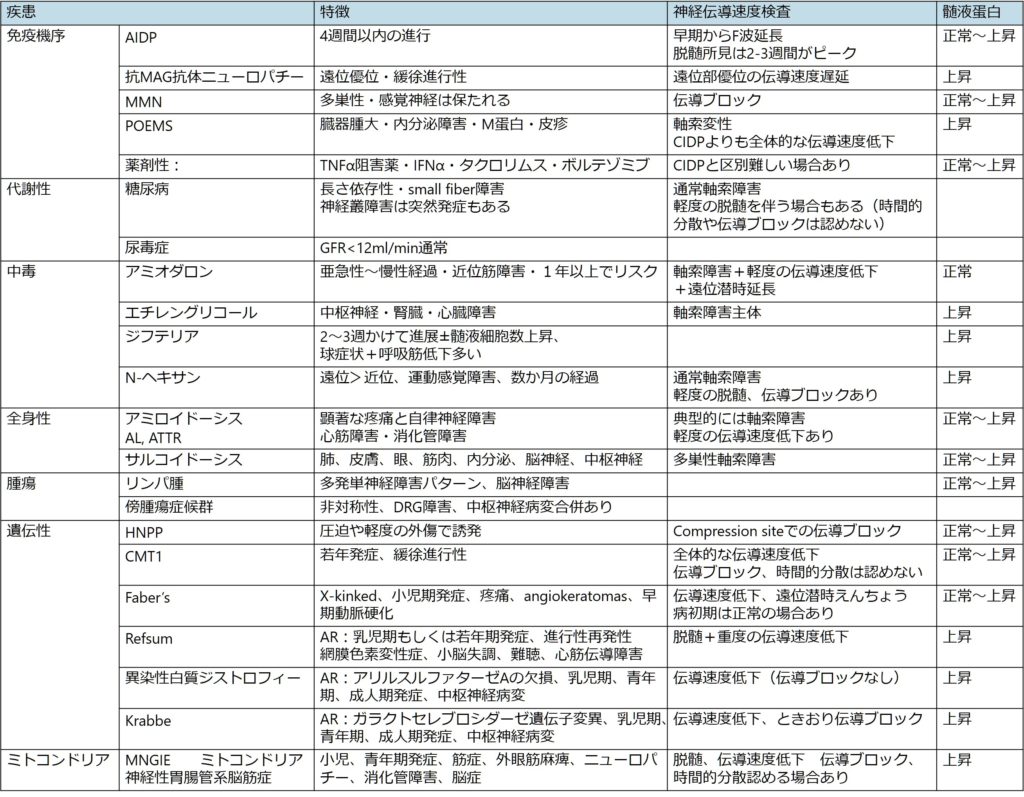
CIDPの診断で特に注意が必要なのが、atypical CIDPを診断する場合です。atypical CIDPと診断する場合は、傍証を集めることと(もしparanodalなものを疑う場合は各種抗体提出など)、鑑別診断をきちんと行うことが極めて重要です(straightforwardにatypical CIDPを診断できると思わない方が良いということです)。遠位部優位に障害をきたすDADSは特に鑑別が多いため注意が必要です。これはPOEMS症候群、抗MAG抗体ニューロパチーなど遠位部優位に障害をきたす脱髄性ニューロパチーの鑑別や、アミロイドーシスなども鑑別です。以下に鑑別をまとめます。
治療
CIDPの治療は大きく再燃時の治療と慢性期維持療法の2つに分けることが出来ます。それぞれに関してまとめます。いずれの場合も治療のメルクマールとして客観的な指標を設定することが極めて重要です(主観的には良くなったと感じてしまう場合も多い)。一般的には握力やINCATスケールなどをメルクマールとして利用することが多いです(その他6分間歩行距離、MMTなど)。特に診断根拠として免疫治療反応性を組み込む場合に注意が必要です。
IVIg、ステロイド、血漿交換療法はいずれも1st line therapyとして確立しています(奏効率はそれぞれIVIg 78%, ステロイド 64%, 血漿交換療法 66% Eur J Neurol 2010;17:289)。このうちどれがより優れているというものはないですが、実臨床ではステロイドの効果発現に時間がかかるためまずIVIg(もしくは血漿交換療法)から導入する場合が多いと思います。
これらの治療に反応しない場合はもちろん治療適応性のNF155などの可能性もありますが、まず「CIDPという診断がmisdiagnosisの可能性はないか?」を検討します。またこのなかの1つの治療法に反応しない場合は、1st line therapy内での別の治療法をまず検討します(その他の免疫抑制剤を使用するのではなく)。1st line therapyのいずれかは約80%で奏功するとされています。
1:IVIg
・効果発現は施行から6週間以内が目安(8週間継続しても効果がみられない場合は無効例として治療法を変更検討)
・前述の抗NF155抗体や抗CNTN1抗体陽性例で反応性が不良
・維持療法としても用いられます
2:副腎皮質ステロイド
・60mg/dayから開始、治療効果を確認した後漸減中止を行う
・投与から効果発現までの期間は1st line therapyのうち最も長く数週間から3か月程度とされる(12週間継続しても効果がみられない場合は無効例として治療法を変更検討)
3:血漿浄化療法
・効果発現は施行後1か月以内と早い(8週間継続しても効果がみられない場合は無効例として治療法を変更検討)
・前述の抗NF155抗体や抗CNTN1抗体陽性例などのIVIg治療抵抗例に有効性が期待される(IgG4サブクラスはIAPPで除去されない点に注意が必要です。血漿交換療法に関してはこちらをご参照いただければと思います。)
維持療法
定期的なIVIGもしくは血漿交換療法が施行されます。定期的なIVIG療法が一般的でエビデンスも方くです。一般的には1~2g(1クールあたり)を4~8週おきに投与する方法がとられます。IVIG必要量を減らすために、ステロイドの併用やsteroid-sparingとして免疫抑制剤の併用を行いう場合が多いです。
免疫抑制剤
アザチオプリン・MMF・シクロスポリン・シクロフォスファミドを用いる場合があります。どの免疫抑制剤を推奨するというものはありません(いずれの薬剤においても前向き研究はありません)。MTXはRCTで有用性を証明できませんでした。難治例ではリツキシマブや造血幹細胞移植などを検討する報告もあります。
以上CIDPに関してまとめました。まだまだ不十分なので今後適宜このchapterはup dateしていく予定です。
*参考:日本のCIDPに関する疫学研究 Neurology ® 2024;102:e209130.
患者数約4000人(4180人) 解析1257例
性別男女比 1.5:1, 中央値年齢 52歳
CIDP病型:typical CIDP 52%, distal 17%, multifocal/focal 17%, sensory 6%, motor CIDP 4%
初期治療内容:IVIg 72%, steroid 15%, others 13%
参考文献
・Lancet Neurol 2019; 18: 784–94:CIDPに関する最近の素晴らしいreviewです。
・Nat. Rev. Neurol. 7, 507–517 (2011)
・Neurol Ther (2020) 9:43–54:CIDP誤診に関してまとめたreviewです。臨床的示唆に富んだ内容で素晴らしいです。臨床経験の強さを感じます・・・。
・BRAIN and NERVE 72 (4):417-423,2020「神経伝導検査」 CIDPと誤診された症例の解説があります。


