- 1 薬剤総論
- 1.1 背景となる重要な臨床試験の紹介
- 1.1.1 レボドパには神経毒性はない ELLDOPA study “Levodopa and the Progression of Parkinson’s Disease” NEJM 2004;351:2498
- 1.1.2 レボドパには疾患修飾作用はない LEAP trial ”Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease” N Engl J Med 2019;380:315-24.
- 1.1.3 運動合併症はレボドパ治療期間ではなく疾患罹病期間とレボドパ1日投与量に関連する ガーナStudy “The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa” Brain 2014: 137; 2731–2742.
- 1.1 背景となる重要な臨床試験の紹介
- 2 薬剤
- 3 非運動症状に対する薬物治療
- 4 LEDD=Levodopa equivalent daily dose
- 5 デバイス補助療法への切り替え
- 6 治療戦略の検討
- 7 周術期・内服困難時の薬剤
薬剤総論
・疾患修飾作用(進行を遅らせることができる薬剤)の確立した薬剤はない。
・現状使用することができる薬剤はいずれも対症療法薬である。
・初期はtherapeutic windowが広い(honeymoon period)が,進行してくるとtherapeutic windowが狭くなり至適な薬物血中濃度を保つことが難しくなる(投与量が多すぎるとdyskinesiaを生じ,少ないとoffになる)
下図引用元:JAMA. 2020;323(6):548-560.
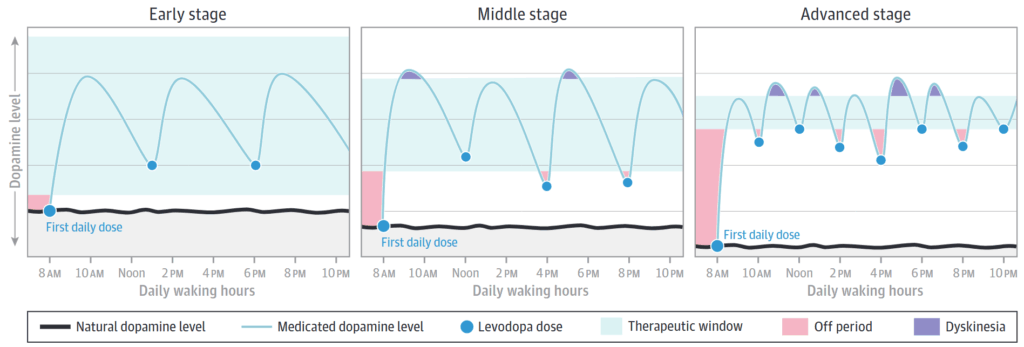
・進行期の症状変動に関して
①ドパミン神経細胞:ドパミンをシナプス小胞で蓄えられ,D2受容体のnegative feedbackやDATによる再取り込みによりシナプス間隙のドパミン濃度を調整している(このため半減期が短くても長時間作用する)
②セロトニン神経細胞:AADCを有しているためレボドパをドパミンに代謝できるが,D2受容体やDATを有さないためドパミンを貯蔵し,濃度調整をすることができない
⇒進行期になるとセロトニン神経を借りるが,上記特性からシナプス間隙のドパミン濃度は血中濃度に依存する=short duration responseが大きくなる
背景となる重要な臨床試験の紹介
レボドパには神経毒性はない ELLDOPA study “Levodopa and the Progression of Parkinson’s Disease” NEJM 2004;351:2498
デザイン:double-blinded RCT
患者:早期PD患者361人
介入:プラセボ or レボドパ150mg/日 or レボドパ300mg/日 or レボドパ600mg/日を40週間投与⇒その後2週間の薬剤washout期間を設ける
評価項目:ベースラインから42週間後(薬剤離脱後)までのUnified Parkinson’s Disease Rating Scale (UPDRS) の総スコアの変化
結果:下図(LimitationとしてWashout periodが短すぎる可能性がある)
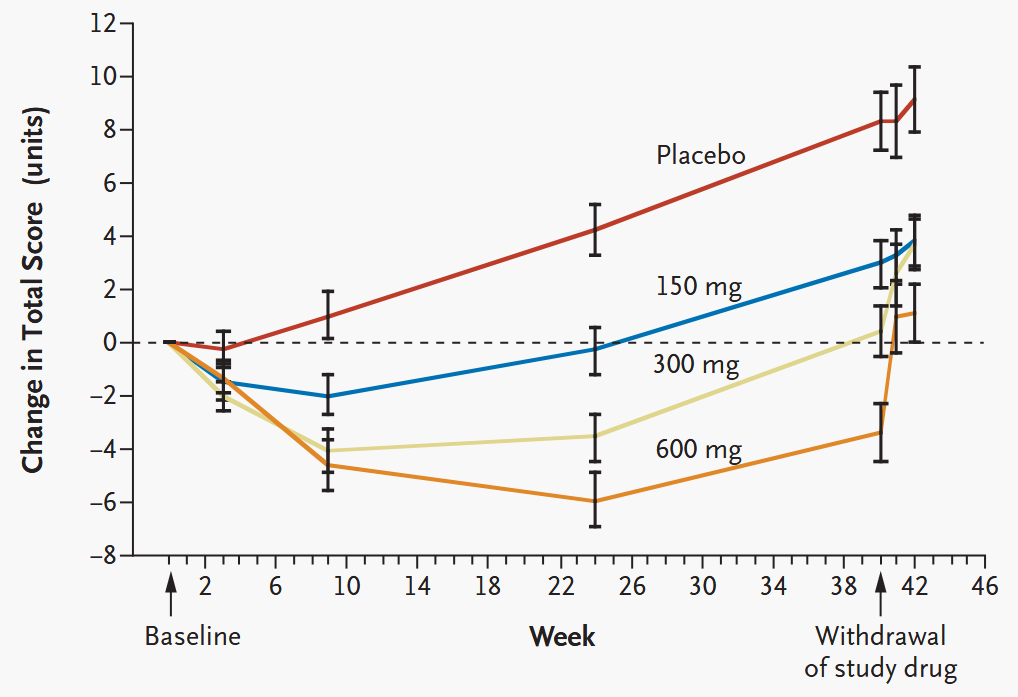
⇒①レボドパがパーキンソン病を進行させることはない
②しかしDAT SPECTの結果からはレボドパがドーパミン作動性ニューロンに毒性作用を持つ可能性についての懸念がある
レボドパには疾患修飾作用はない LEAP trial ”Randomized Delayed-Start Trial of Levodopa in Parkinson’s Disease” N Engl J Med 2019;380:315-24.
目的: 早期のパーキンソン病患者において、レボドパに疾患修飾効果があるかどうかを評価
デザイン:double-blinded RCT(オランダ多施設共同)
患者:早期パーキンソン病(障害が弱い)445名 80週間追跡 評価項目:UPDRS総スコア
early-start group:レボドパ300mg/日 80週投与
delayed-start group:placebo 40週間後⇒レボドパ300mg/日40週
結果:早期開始群で−1.0±13.1点、遅延開始群で−2.0±13.0点 *有意差なし
⇒レボドパ早期に開始しても遅らせても運動機能は不変
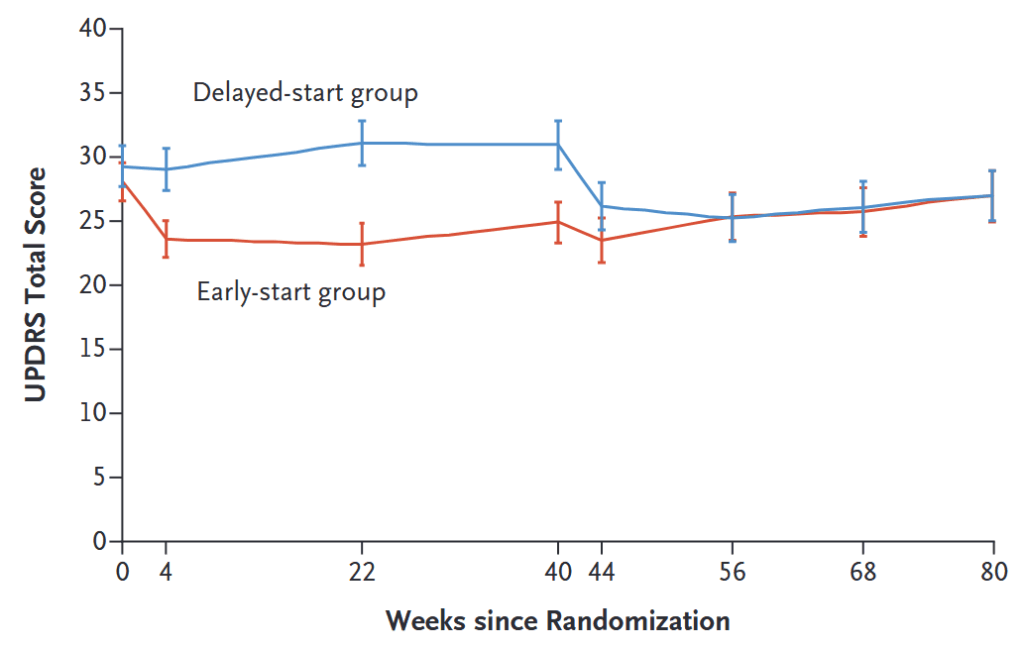
副作用:運動合併症(ジスキネジアなど)両群で有意差なし 嘔気は早期開始群で有意に多い結果
結論:レボドパに疾患修飾効果,毒性効果はいずれもないことを示唆する
運動合併症はレボドパ治療期間ではなく疾患罹病期間とレボドパ1日投与量に関連する ガーナStudy “The modern pre-levodopa era of Parkinson’s disease: insights into motor complications from sub-Saharan Africa” Brain 2014: 137; 2731–2742.
・目的:運動合併症の発生が主にレボドパ療法の期間に関連しているのか、それとも疾患関連要因に関連しているのか(ガーナは発症から治療開始までの期間が遅れることから,イタリアの診断例を対照ととして)
・レボドパ開始時の平均疾患期間: ガーナ 4.2年 vs. イタリア 2.4年(P<0.001)
・運動合併症発生時の疾患期間: motor fluctuations/dyskinesia最初の出現時の疾患期間の中央値は、両集団間で同等
◦ 運動動揺発生時:ガーナ 6.0年 vs. イタリア 5.5年(P = 0.149)。
◦ ジスキネジア発生時:ガーナ 7.0年 vs. イタリア 6.5年(P = 0.567)。
レボドパ曝露期間: 運動合併症発生時、ガーナ患者はイタリア患者よりも有意に短い
◦ 運動動揺発生時:ガーナ 0.5年 vs. イタリア 2.0年(P = 0.001)。
◦ ジスキネジア発生時:ガーナ 1.0年 vs. イタリア 3.0年(P = 0.004)
結論:運動合併症は疾患期間およびレボドパ一日量(体重あたりmg/kg)に関連しており、レボドパ療法の期間とは関連していない
⇒早く治療を開始して良い=運動療法の発生を遅らせることを目的としてレボドパ投与を控えることは推奨されない
薬剤

レボドパ製剤
効果:運動障害に対して最も確立した薬剤(診断的治療にも有用である)
・効果が出やすい症状:筋強剛,無動/寡動,歩行障害の一部
・効果が出づらい症状:姿勢反射障害,すくみ足,嚥下障害,非運動症状(認知障害,精神症状,起立性低血圧)など
作用機序:末梢性脱炭酸酵素(AADC)によりドパミンへ代謝(効果を発揮するためにはドパミンへの代謝が必要である)
半減期:30-90分
種類(DCI合剤)
・レボドパ100mg + カルビドパ10mg(AADC阻害薬) 商品名:ドパコール®,ネオドパストン®,メネシット®
・レボドパ100mg + ベンセラジド25mg 商品名:イーシー・ドパール®,マドパー®
| 一般名 | レボドパ100mg +カルビドパ10mg | レボドパ100mg +ベンセラジド25mg |
|---|---|---|
| 商品名 | ドパコール® ネオドパストン® メネシット® | イーシー・ドパール® マドパー® |
食事:レボドパは十二指腸下部~小腸で吸収される,乳製品の同時摂取は避ける(吸収低下),内服タイミングは食前にすると吸収が増えかつピークが早まる(初期は食前だと嘔気強くなるため基本は食後から開始する) *便秘コントロール悪いと吸収に悪影響がでる可能性あり注意
レボドパ製剤を開始する場合(食後):レボドパ50mg +ドンペリドン10mg 3錠分3食後 または レボドパ100mg + ドンペリドン10mg 2錠分2朝夕食後 (300mg/日での開始は多すぎるし消化管副作用がでる)
レボドパの効果に関して
short duration response (SDR) / long duration response (LDR)
・レボドパの効果は数時間持続する即時的なshort duration response(SDR)と数日持続する持続的なlong duration response(LDR)に分類される
・SDRはレボドパ投与後の血漿ドパミン濃度とほぼ一致する
・早期PD患者ではLDRが主な反応になる,進行期になるとLDR持続時間が短縮する
・LDRの機序は不明であるが,可塑性が関与している可能性がある
・ドパミンアゴニストでもLDRを生じることがある
まとめ:Parkinsonism and Related Disorders 2011;17:587e592.より
| 特徴 | short duration response | long duration response |
|---|---|---|
| 反応確立までの時間 | 即時 (Immediate) | 慢性的投与が必要 (Chronic dosing required) |
| 反応の持続時間 | 数時間 (Hours) | 数日~数週間;疾患の進行と共に短縮 (Days to weeks; shrinks with disease progression) |
| レボドパ中止後の運動効果の消失 | 即時 (Immediate) | 数週間 (Weeks) |
| レボドパ効果全体への寄与 | 半分から3分の2 (Half to 2/3) | 3分の1から半分 (One third to a half) |
| ジスキネジアとの関連 | あり (Yes) | なし (No) |
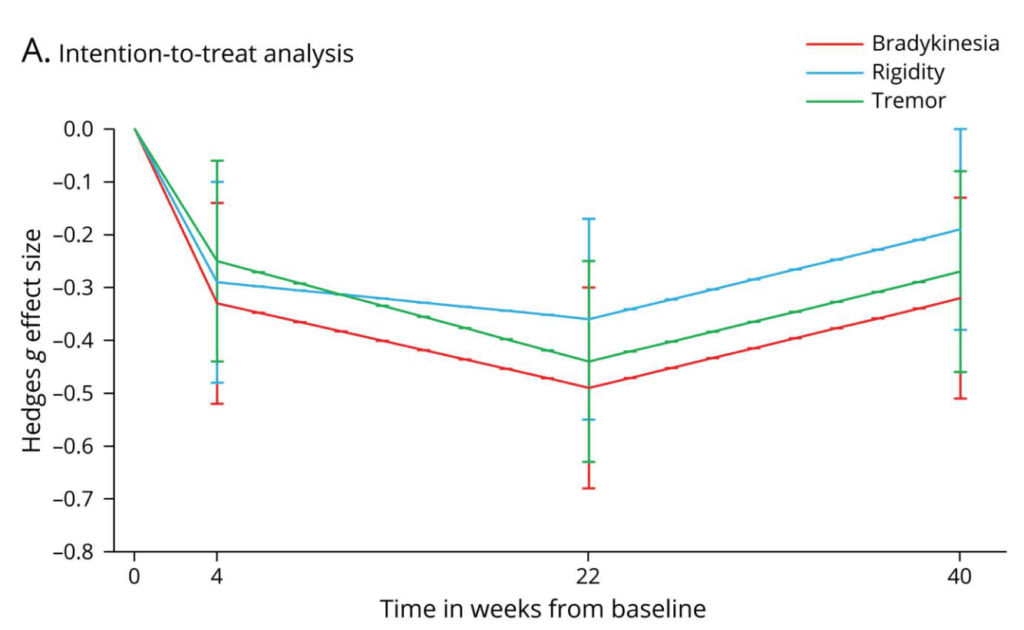
“Levodopa Response in Patients With Early Parkinson Disease” Neurology® 2023;100:e367-e376. LEAP試験のpost hoc analysis
・無動,固縮,振戦について検討
⇒それぞれ同程度の改善効果を示した(UPDRS part 3の各項目から)
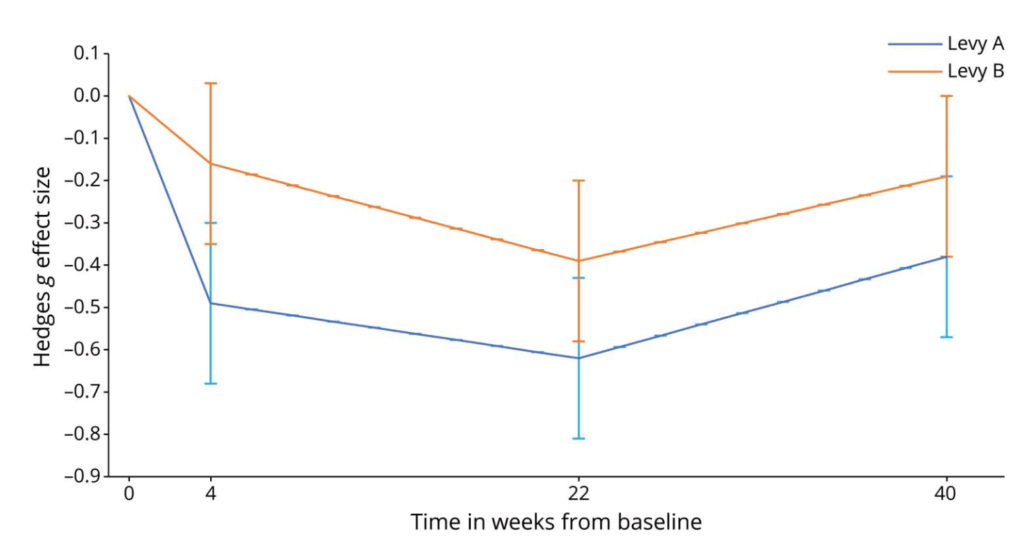
・改善しやすいLevy A, 改善しづらい Levy B scoreについて検討
⇒Levy Aの方がLevy Bよりも改善効果があるものの,Levy Bもプラセボよりは改善効果あり
・Long duration response:レボドパの効果は22週間>4週間の結果であり合致する
⇒レボドパ最大効果は4-22週の間に認める(long duration response)
LID(levodopa induced dyskinesia)に関して
“Levodopa-induced dyskinesia in Parkinson disease A population-based cohort study” Neurology® 2018;91:e2238-e2243.
・309人パーキンソン病患者 90.3%(n=279)がレボドパ治療 *大多数はMayo Clinicの医師により治療
・定義:LID(levodopa induced dyskinesia) ピーク時投与量の舞踏病様運動 *ジストニアは含まず
・ジスキネジア 30.1%に認めた
・発症時期:レボドパ開始からDyskinesia発症までの中央値4年 レボドパ開始から5年以内発症 55%
・ジスキネジアの重症度:軽度が57例(67.9%)、中等度が16例(19.1%)、重度が9例(10.7%)
・治療:薬剤調整 60.7%⇒そのうち45.1%が改善 DBS 15.5%⇒全例dyskinesiaの顕著な改善
・リスク因子:高用量レボドパ,発症年齢の若さ
ドパミン受容体刺激薬
・効果:運動症状改善(レボドパよりも弱い)
*Yahr3以上でドパミンアゴニスト単独での管理は厳しい(ドパミンアゴニストを増量してレボドパと同等の効果が得られるのはYahr2まで)
*レボドパで効果が乏しい運動障害に対してドパミンアゴニストの方が有用なことは稀
*アゴニストの併用療法に関してはエビデンスはない(基本しない)
・作用機序:直接的なドパミン受容体刺激
・種類
| 一般名 | ロピニロール | プラミペキソール | ロチゴチン | |
| 商品名 | レキップ | ハルロピテープ | ミラペックス | ニュープロパッチ |
| 半減期 | 徐放 13.6時間 | 徐放 8.4時間 | ||
| 開始量 | 2mg/日 | 8mg/日 | 0.375mg/日 | 4.5mg |
| 最大量 | 16mg/日 | 64mg/日 | 4.5mg/日 | 36mg |
それぞれの薬剤の特徴(絶対にこれを使うというものはない)
・プラミペキソール:うつ症状,anhedoniaに有効な場合がある(D3受容体が関与している可能性)
副作用(非麦角系)
・精神症状,日中過眠(突発睡眠),衝動制御障害(ICD 病的賭博・性欲亢進),姿勢異常(悪化させる場合がある),浮腫,起立性低血圧,消化管
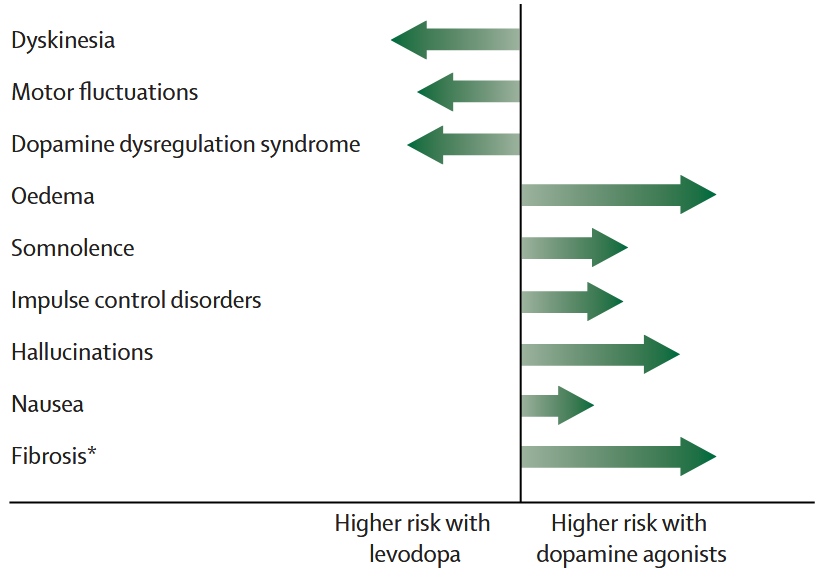
レボドパとドパミンアゴニストの副作用の違い 下図:Lancet Neurol 2009; 8: 929–37.より引用
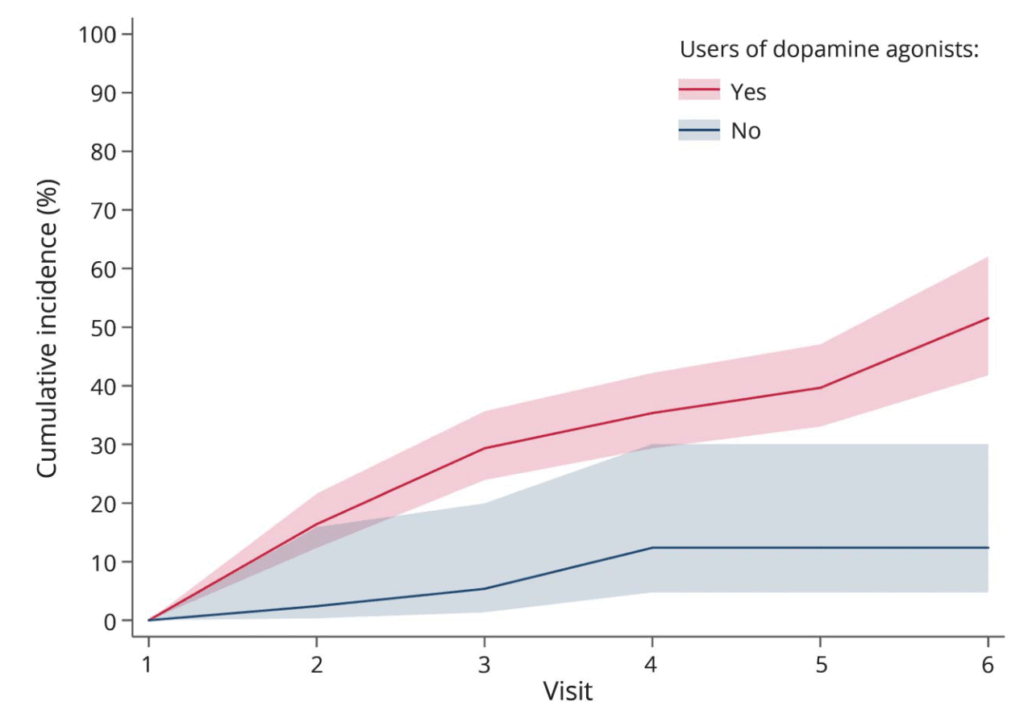
衝動制御障害(ICD):病的賭博、性欲亢進、衝動買い、無茶食い、punding(単純で無意味な行動の反復)
“Longitudinal analysis of impulse control disorders in Parkinson disease” Neurology® 2018;91:e189-e201.
・5年間のICDの累積発生率は全体で46.1%(DAあり 51.5%, DAなし 12.4%)
・一度でもDAを使ったことがある患者のICD有病率比は4.23, 投与量と治療期間のそれぞれに用量依存的な関係がある(レボドパやその他のパーキンソン病薬には関係なし)
・アゴニスト間では有意差なし
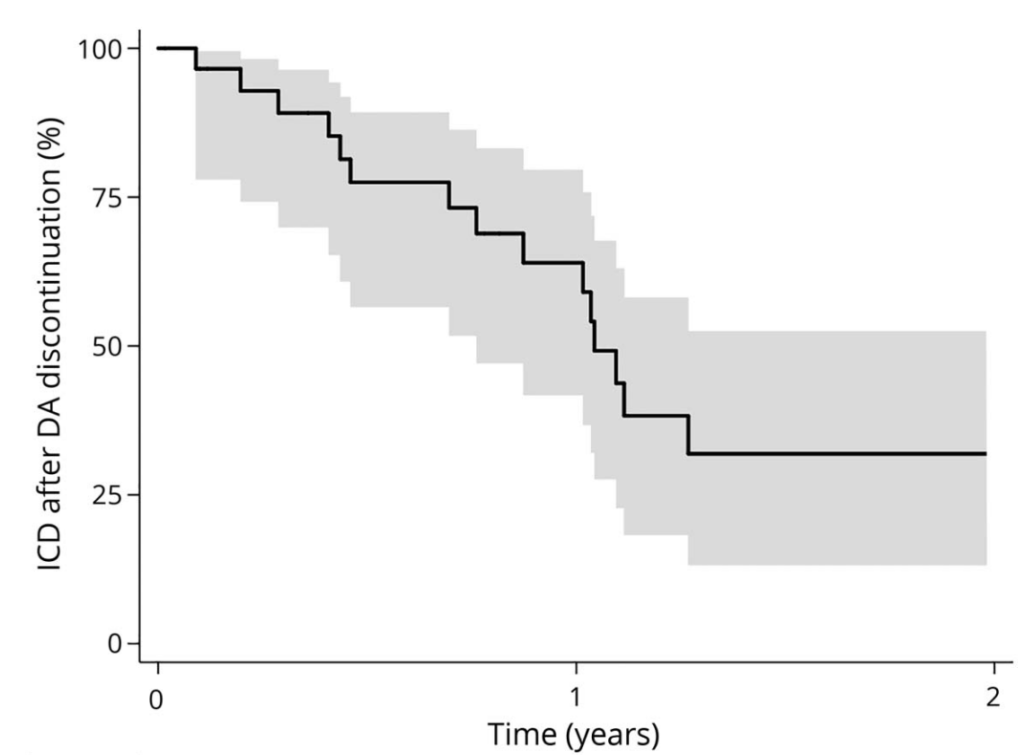
ドパミンアゴニスト中止後のICD⇒DA中止後徐々に改善する(1年後には約50%がICDなし)
離脱症状 DAWS(dopamine agonist withdrawal syndrome)
・減量中止時に生じる 頻度15.5-19%
・ドパミンアゴニストの再開で改善する(レボドパでは改善しない)
・症状:精神症状(不安、抑うつ、焦燥)と自律神経症状(発汗、起立性低血圧、疲労)
・リスク因子:ICD、投与量が多い
MAO-B阻害薬
効果:運動機能の改善(若年発症は初期MAOBI単剤で使用する場合もある)
*すくみ足に対して有用な可能性あり
作用機序:モノアミンドパミン分解酵素を阻害することで濃度を高める(ドパミンだけではなく,ノルアドレナリンやセロトニンの分解も抑制する作用を有する)
各薬剤
| 項目 | セレギリン | ラサギリン | サフィナミド |
|---|---|---|---|
| 商品名 | エフピー® | アジレクト® | エクフィナ® |
| MAO-B阻害効果 | 不可逆的 | 不可逆的 | 可逆的 |
| MAO-A阻害効果 | 弱いがあり | 過量投与で出現することあり | 弱いがあり |
| 製剤 | 錠剤 2.5 mg | 錠剤 0.5 mg / 1.0 mg | 錠剤 50 mg |
| レボドパ100 mg等価量 | 10 mg | 1.0 mg | 150 mg |
副作用:起立性低血圧(注意),めまい,精神症状,傾眠,衝動制御障害,セロトニン症候群
併用禁忌(多いため必ずチェック必要!):SSRI,SNRI,トラマドールなど
食事:チラミン高含有食品(熟成チーズ,燻製,キムチなど)に注意する(チラミン代謝阻害が生じる)⇒チラミン中毒(血圧上昇,頭痛,嘔吐,発汗,動悸など)
周術期(こちら):事前休薬が必要であるため要注意!
レボドパはレボドパ温存療法(DAまたはMAOBI)と比較して、患者が評価するQOLに小さくとも持続的な利益をもたらし、長期的なアウトカムを悪化させる懸念はない
COMT阻害薬
・効果:レボドパ効果時間の延長
・作用機序:レボドパ分解し血中濃度を維持する
・副作用:ジスキネジア,幻覚
・種類
| 一般名 | エンタカポン | オピカポン |
|---|---|---|
| 商品名 | コムタン | オンジェンティス |
| 投与方法 | レボドパ内服時,それぞれ50-100mg | 25mg 1日1回 |
抗コリン薬
・効果:振戦に対して有用(若年PDや早期に有用であるが,進行期には効果不十分)
・作用機序:パーキンソン病では相対的コリン過剰状態であり、そのバランスを取ることで効果があるとされている
・副作用:特に高齢者は要注意 認知機能低下,幻覚,排尿障害,口渇,眼のかすみなど
・一般名:トリヘキシフェニジル、商品名:アーテン®
・製剤:2mg/錠,細粒
・投与量:1~3mg/日程度 *中止する場合は漸減が望ましい
⇒副作用の観点から基本的には使用を控え,若年で認知機能正常,他剤でも振戦コントロール不良の場合に考慮する
ゾニサミド
・効果・特徴:オフ時間短縮,振戦(その他の薬剤と比較すると比較的ジスキネジアや幻覚を悪化させづらいため忍容性が高め)
・副作用:眠気、発汗低下など
・商品名:トレリーフ®
・錠剤:25mg, 50mg 半減期:94時間 代謝:肝代謝
・投与量:開始25mg⇒運動症状改善50mg/日
イストラデフィリン
・効果:Wearing offでのOff時間短縮
*眠気が強い人で投与することがある、ジスキネジア悪化することあり
・作用機序:Adenosine A2A受容体拮抗薬
・商品名:ノウリアスト®
・製剤:20mg/錠
・投与量:20mg 1錠分1(最大投与量:2錠分1=40mg/日)
アマンタジン
・効果:ジスキネジア(唯一ジスキネジアに対して治療効果がるのがアマンタジン)
・作用機序:NMDA受容体拮抗薬
・副作用:精神症状(幻覚)、ミオクローヌス 中毒域と治療域が近い *腎機能で投与量を調整する必要がある
非運動症状に対する薬物治療
まだまだエビデンスは不十分である
下表はLancet 2024; 403: 305–24より引用
| 治療 | 注意点 | |
|---|---|---|
| 抑うつ/不安 | プラミペキソール、MAO-BI、SSRI、SNRI、三環系抗うつ薬。CBT、マインドフルネス、運動、ブライトライトセラピーなどの非薬物療法。 | 多くのNMSはドパミンのオフ状態を反映している可能性があり、レボドパの調整が助けとなることがあります。SSRIやSNRIはMAO-BIとの併用でセロトニン症候群のリスクが理論上ありますが、臨床的には稀です。 |
| 精神病 | 非定型抗精神病薬:クロザピン、ピマバンセリン、クエチアピン。コリンエステラーゼ阻害薬(ChEIs)。 | クロザピンが最も有効ですが、無顆粒球症のリスクがあるため、厳格な血液モニタリングが必要です。他の非定型抗精神病薬は運動症状を悪化させる可能性があります。 |
| 認知機能障害/認知症 | ChEIs(リバスチグミンは臨床的に有用)。ドネペジルも使用される。 | ChEIsは、認知機能低下を遅延または予防する効果はないとされています。血管性疾患やアルツハイマー病理など、複合的な病理が原因となることがあります。 |
| 流涎(よだれ) | グリコピロレート、ボツリヌス毒素注射(タイプAまたはB)。 | ボツリヌス毒素注射は、適切な訓練を受けた医療提供者が実施すれば、有効で安全性が高いです。 |
| 起立性低血圧(OH) | ドロキシドパ(短期的に臨床的に有用)、ミドドリン、フルドロコルチゾン。 | 非薬物療法(塩分・水分摂取量の増加、ベッドの頭の挙上)が初期管理の基本です。ドロキシドパは世界的に利用可能ではありません。 |
| 便秘 | プロバイオティクス/プレバイオティクス(マルチストレイン)、マクロゴール、ルビプロストン。 | 便秘はレボドーパ吸収を妨げるため、初期管理(運動、食事改善、水分補給)が重要です。 |
| 睡眠障害 | 制御放出型レボドーパ、ドーパミンアゴニストの最適化。アポモルヒネ夜間注入(不眠症)。メラトニン、クロナゼパム、トラゾドン。 | **レム睡眠行動障害(RBD)**には、クロナゼパムやメラトニンが広く使用されますが、エビデンスは不足しています |
LEDD=Levodopa equivalent daily dose
・全パーキンソン病薬をLevodopa1日換算量に変換したものがLEDD(Levodopa equivalent daily dose)
・文献により異なるが以下はMovement Disorders 2010;25:2649–53.を参照
| 種類 | 薬剤 | LEDD換算 |
|---|---|---|
| COMT阻害薬 | エンタカポン | ×0.33 |
| ドパミン受容体作動薬 | プラミペキソール (ミラペックス®) | ×100 |
| ロピニロール (レキップ®) | ×20 | |
| ロチゴチン (ニュープロパッチ®) | ×33 *×20 | |
| MAOB阻害薬 | セレギリン (エフピー®) | ×10 |
| ラサギリン (アジレクト®) | ×100 | |
| その他 | アマンタジン (シンメトレル®) | ×1 |
デバイス補助療法への切り替え
“5-2-1 rule”:デバイス補助療法の適応を検討する際の基準
- 1日にレボドパ投与回数が5回以上
- 1日のオフ症状(薬効切れ時間)が2時間以上
- 1日にジスキネジアが1時間以上
適応条件
・PDの診断
・レボドパ反応性が明瞭
・適切な治療でもwearing off/ dyskinesiaの日内変動が大きい
・70歳以下
・認知機能正常,精神症状問題なし
・各治療の禁忌事項なし(胃瘻造設可能かどうかなど)
治療戦略の検討
PD MED trial Lancet 2014; 384: 1196–205
目的:パーキンソン病の初期治療として、レボドパ、ドパミンアゴニスト、モノアミン酸化酵素B阻害薬(MAOBI)のうち、どれが最も効果的な長期的な症状コントロールとQOL改善に寄与するのかを検討(特にレボドパとレボドパ温存のStrategyの違い)
デザイン:open-label RCT
対象:早期パーキンソン病1620名
評価項目:パーキンソン病質問票(PDQ-39)の移動度(mobility)ディメンションのスコア
結果(有効性):PDQ-39,Yahr分類レボドパ群はレボドパ温存群よりも有意に良い
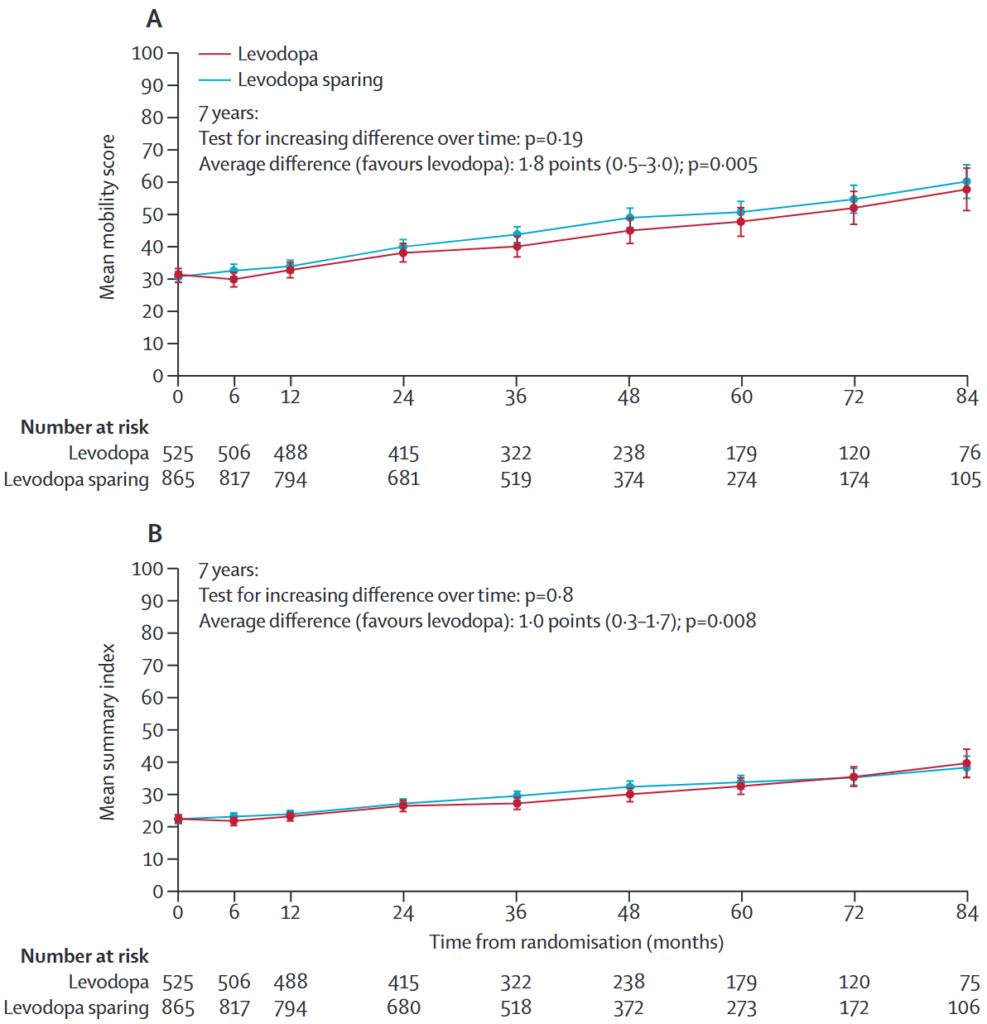
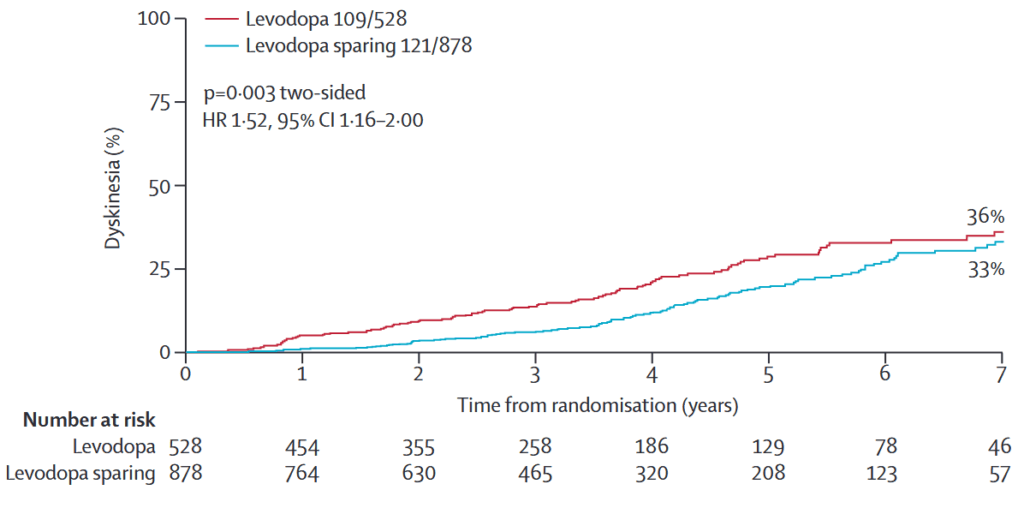
合併症:ジスキネジア レボドパ群がレボドパ温存群よりも有意に多い,motor fluctuations 有意差なし
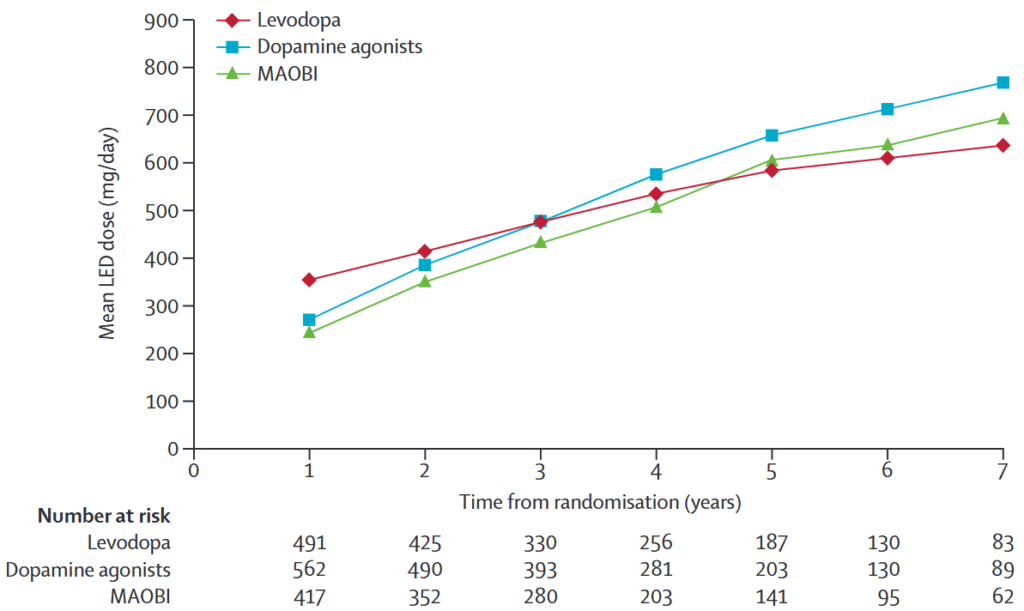
LED(7年前まで):DA群 768 mg/日*、MAOBI群 695 mg/日、レボドパ群 636 mg/日
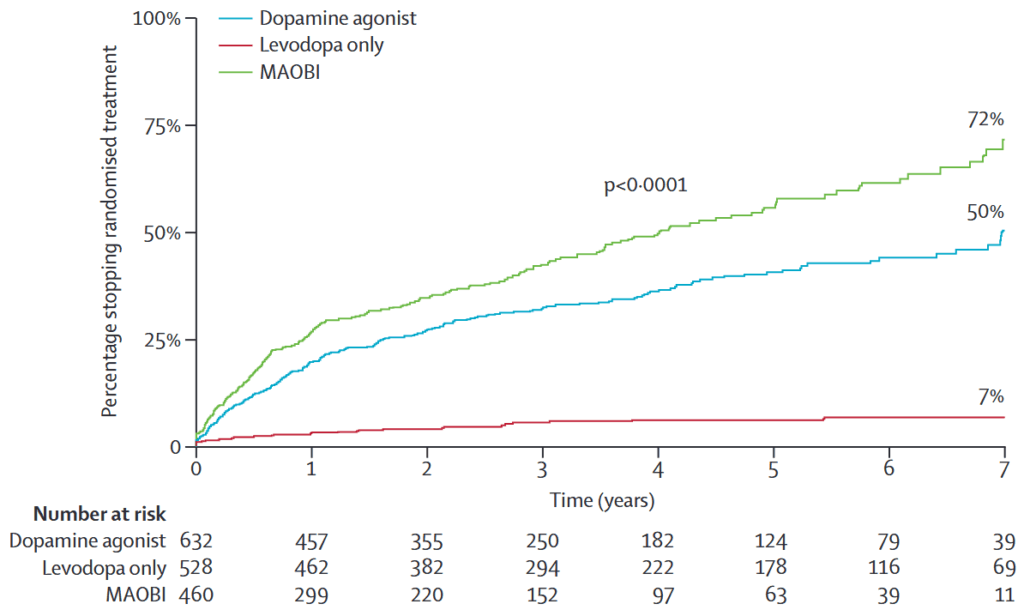
副作用による薬剤中止:DA 28%、MAOBI 23%m レボドパ2%
有効性がなく薬剤中止:MAOBI 17%, DA 6%, レボドパ1%
周術期・内服困難時の薬剤
こちらのまとめをご参照ください。


