病態
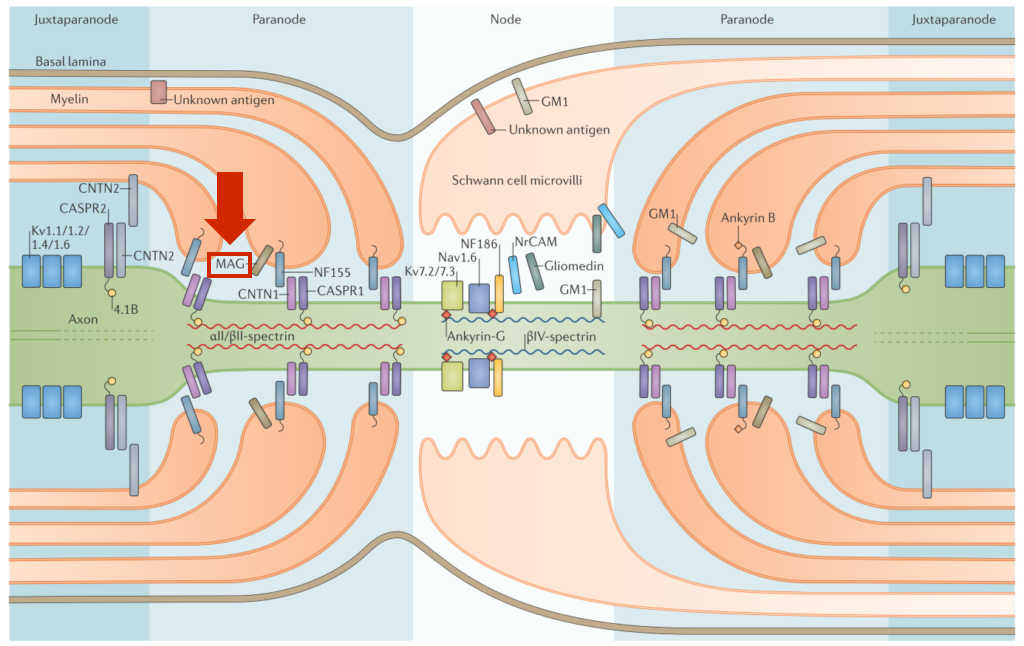
異常蛋白血症に伴うニューロパチーの中に含まれます(異常蛋白血症に伴うニューロパチーに関してはこちらを参照ください)。IgM praproteinemiaに伴うニューロパチーのうち約50%で抗MAG(myelin associated glycoprotein:ミエリン随伴性糖蛋白質)抗体が陽性となります。MAGは髄鞘間の接着因子として機能している髄鞘構成蛋白で、下図の赤矢印部分をご参照ください。このMAGに対する自己抗体により起こるのが抗MAG抗体ニューロパチーです。
下図はhttps://blogs.bmj.com/jnnp/2018/05/20/uncovering-the-clinicopathological-spectrum-in-neuropathy-associated-with-anti-mag-antibodies/より引用。有髄繊維外側のmajor dense line離開による”widely spaced myelin”が特徴的な所見。
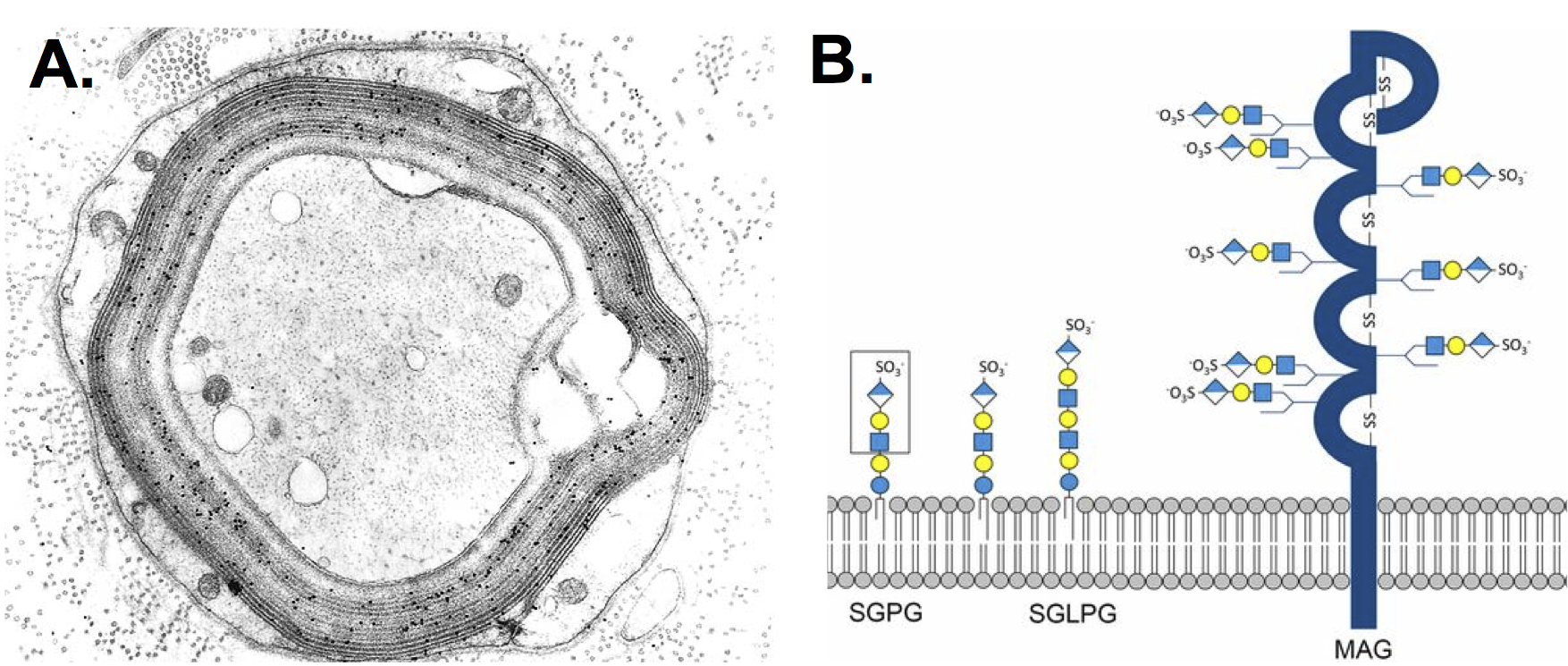
IgMは分子量が非常に大きいのでBNBが生理的に脆弱な神経筋接合部、common compression site、神経根部で自己免疫反応を起こすことが特徴で、この病態は神経伝導検査でも反映されます。
臨床像
非常に緩徐な経過で進行性のlength-dependent, sensory and motor polyneuropathy(下肢遠位部優位、左右対称の感覚障害を認め、感覚障害は表在感覚障害よりも深部感覚障害)が主体となります。進行すると失調性歩行をきたし、車いす移動を余儀なくされるようになります。深部感覚障害を反映して手指振戦をきたす場合もあります。
非典型例ではCIDPの様に下肢筋力低下を亜急性の経過で呈することもあるようで、heterogeneousな疾患のようです。CIDPに関してはこちらにまとめがありますので、もしよければご参照ください。
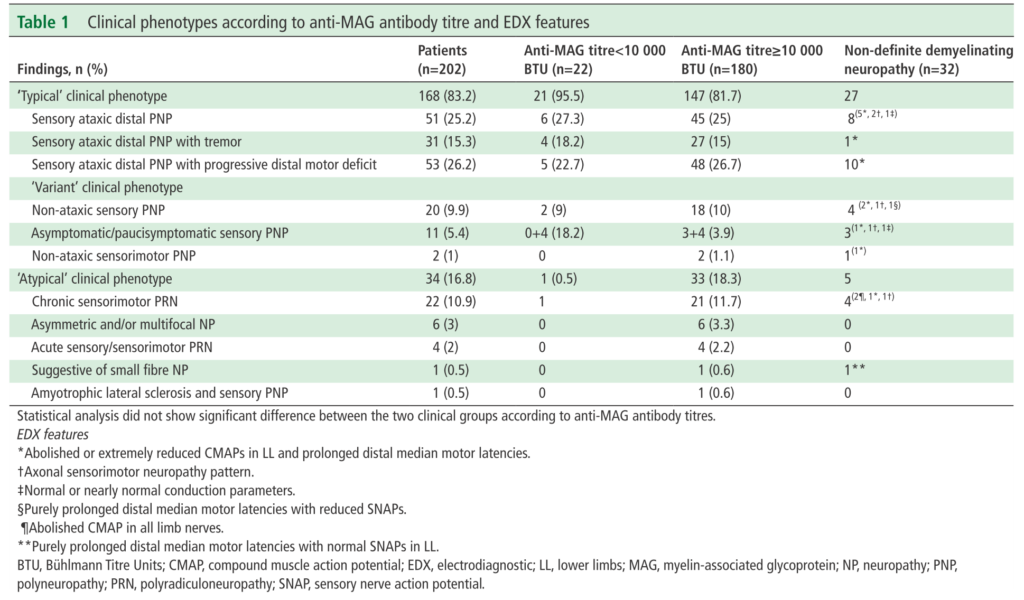
■202例の抗MAG抗体ニューロパチーretrospectiveな検討 J Neurol Neurosurg Psychiatry 2018;89:499–505.
患者背景は男女比=1.9:1、年齢62.6歳、診断までの期間は3.1年、17%(34/202例)は非典型な臨床像を呈したとされています。
進行の経過は急性2.5%、亜急性15.3%、進行性82.2%でその他の症状に関しては下図をご参照ください。
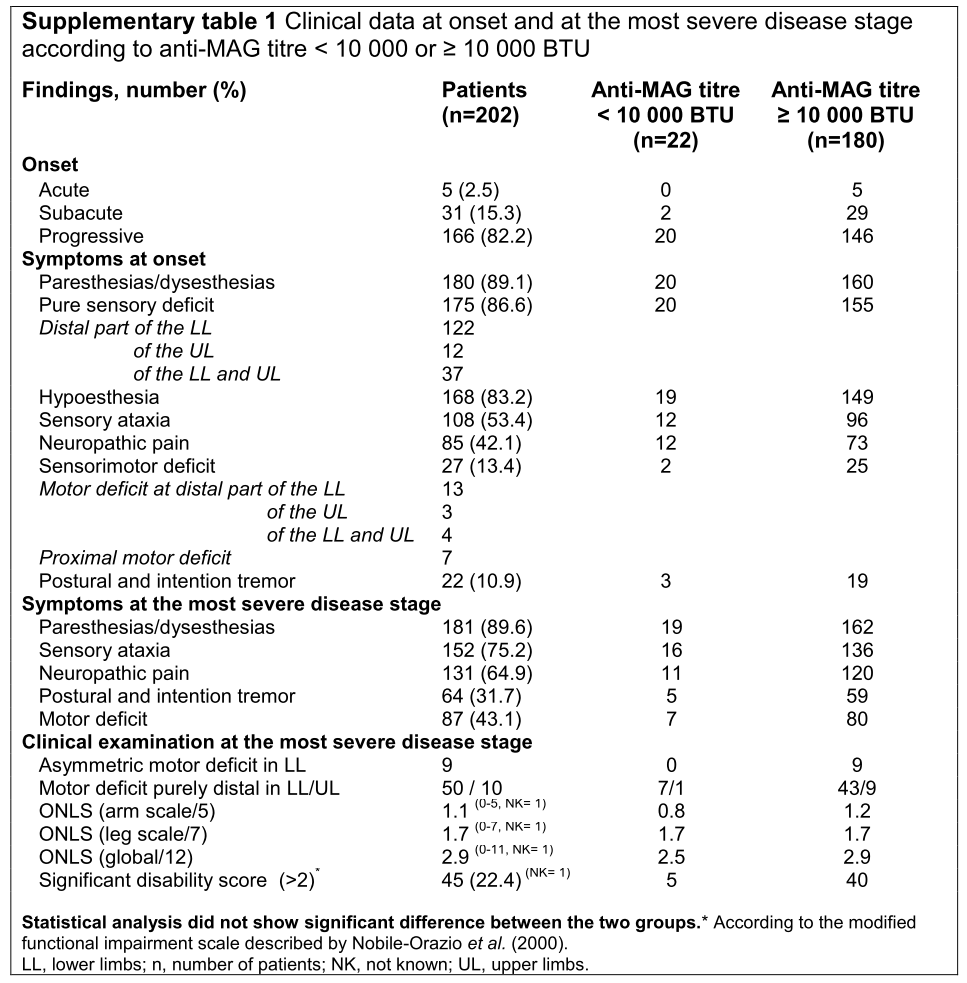
典型例83.2%の内訳は、感覚失調遠位polyneuropathy 25.2%、感覚失調遠位polyneuropathy+tremor 15.3%、感覚失調遠位polyneuropathy + 進行性遠位筋力低下26.2%、非失調型感覚性polyneuropathy 9.9%、無症候性の感覚性polyneuropathy 5.4%、非典型例の内訳は慢性の感覚運動polyradiculoneuropathy 10.9%、左右非対称もしくは多巣性のneuropathy、急性の感覚(運動)polyradiculoneuropathy 2%、small fiber neuropathy 0.5%、ALS+sensory polyneuropathy 0.5%となっています(下図参照)。
検査
血液検査:高IgM血症に伴う末梢神経障害を認めた場合は抗MAG抗体、抗SGPG抗体を測定します(近畿大学、杏林大学さんに測定を依頼させていただくことが多いです)。paraproteimeniaに関しては必ず免疫固定法を実施します。ちなみに、IgM paraproteinemiaに伴う末梢神経障害は抗MAG抗体ニューロパチーだけでなくCANOMAD (chronic ataxic neuropathy, ophthalmoplegia, immunoglobulin M [IgM] paraprotein, cold agglutinins, and disialosyl antibodies)もあります。
髄液検査:特徴的な所見の文献を指摘できず。
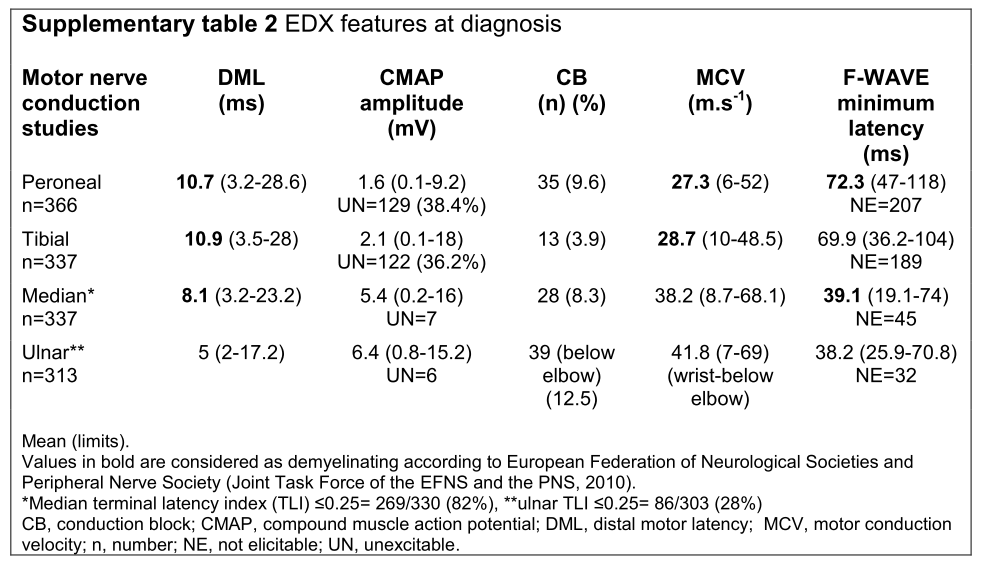
神経伝導速度検査:遠位潜時の著明な延長が何より特徴的で、temporal dispersionやconduction blockを認めることはまれとされています。先のJNNPの文献から電気生理結果を掲載します(J Neurol Neurosurg Psychiatry 2018;89:499–505.)。
治療
■いつから治療を導入するか?
抗MAG抗体ニューロパチーは緩徐進行性の病態なので、当初は感覚障害だけで日常生活ADLにそこまで支障がない場合などは「どのタイミングで治療を導入するか?」が難しい疾患でもあります。失調による歩行障害、転倒、筋力低下などを呈する場合は軸索障害が起こる前に治療介入をするべきと考えられます。
■どの薬剤を使用するか?
ステロイド、IVIG、血漿交換といった既存の免疫療法は効果に乏しいのが現状です。リツキシマブがその中でも最も効果が高いとして期待を浴びておりリツキシマブに関する既報を紹介します。
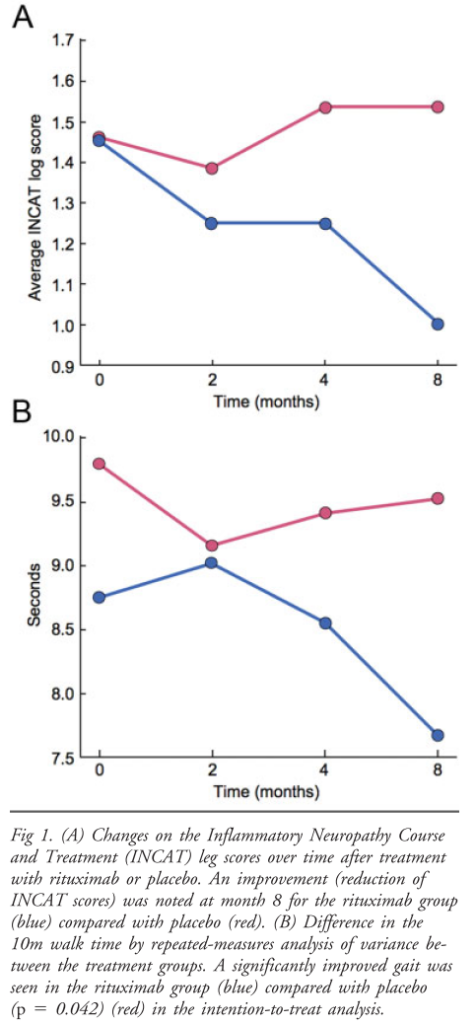
■抗MAG抗体ニューロパチーに対するリツキシマブ投与最初のRCT A-MAG-DP Ann Neurol 2009;65:286–293
P:抗MAG抗体ニューロパチー (n=26)
I:375mg/m2を4週間投与群(n=13)
C:プラセボ投与群(n=13)
O:8か月後のInflammatory Neuropathy Course and Treatment (INCAT) leg disability scoresが1点以上改善 *IgM, MAG抗体価、B細胞数などを2か月おきにフォロー
リツキシマブ投与群でINCAT socre1点以上改善は4/13例(31%)、プラセボ投与群は0/13例でしたが統計学的な有意差は指摘できませんでした(intention to treat 解析でp=0.096)。10m歩行に要する時間はリツキシマブ投与群(7.4±2.5秒)がプラセボ投与群(9.3±3.9秒)に比べて有意に短い結果でした(p=0.042)。これらの臨床上効果は投与後3か月後から出現し、長期維持されることが示唆されました。
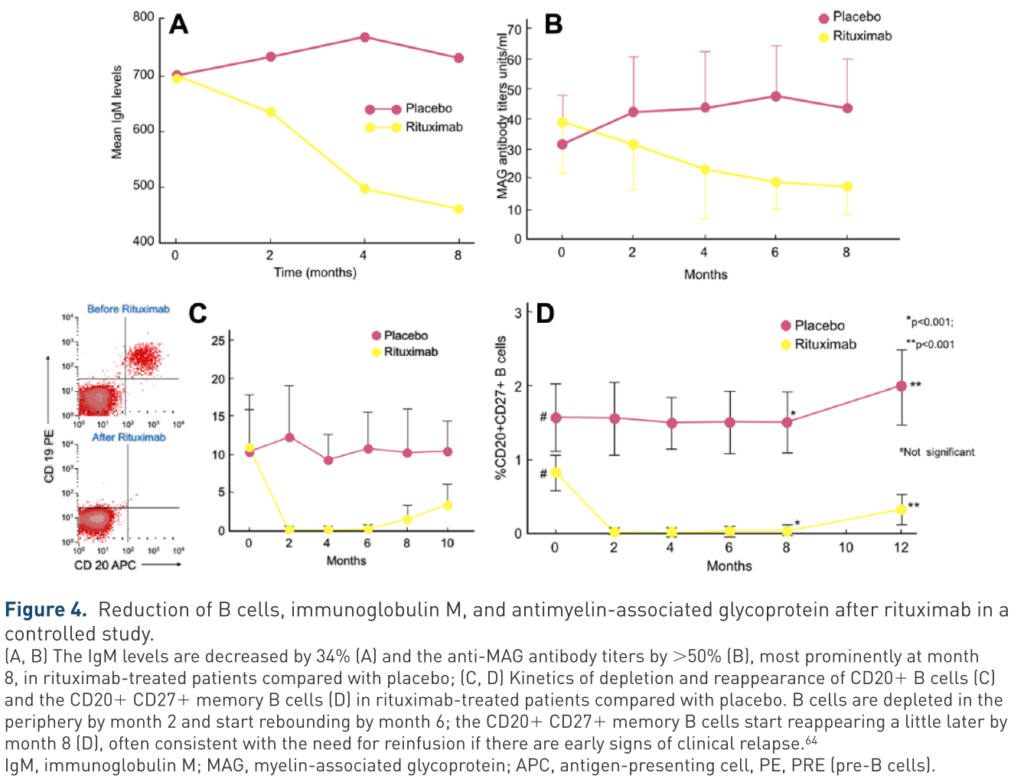
IgM値、MAG抗体値、B細胞数などは下図の通りの推移です。8か月後の時点でリツキシマブ投与によりIgMは34%、MAG抗体価は50%低下しています。
この研究ではprimary outcomeの評価をINCATで設定しており、軽度の感覚障害などの改善をうまくとらえきれていなかった可能性が問題点として言及されています。
■抗MAG抗体ニューロパチーに対するリツキシマブ投与2つ目のRCT Rituximab vs Placebo in Polyneuropathy Associated With Anti-MAG IgM Monoclonal Gammopathy (RIMAG) study Neurology 2013;80:2217–2225
P:抗MAG抗体ニューロパチー54例
inclusion criteria: EFNS/PNSでの慢性脱髄性ニューロパチー基準、IgM peak、抗MAG抗体価>1000 Bühlmann titer units、Inflammatory neuropathy cause and treatment sensory
score ≧4、Visual analog pain scale >4 and/or ataxia score ≧2
exclusion criteria:末梢神経障害をきたすその他の原因、重篤な併存疾患、過去3か月以内の免疫治療、リツキシマブ投与の既往、リツキシマブに対する薬剤過敏性、WBC<1500/μLもしくはPlt<7.5万/μL
I:リツキシマブ375mg/m2 4週間投与 26例
C:プラセボ投与群 28例
O:12か月後のISS(inflammatory neuropathy cause and treatment sensory score)
primary outcomeの評価は前回のRCTでINCATが不適であった反省(前述)を踏まえて感覚障害に重きを置いたISSを設定しています。Primary outcomeに関して”intention to treat”、”per protocol population”いずれにおいても両群で有意差は認めませんでした。
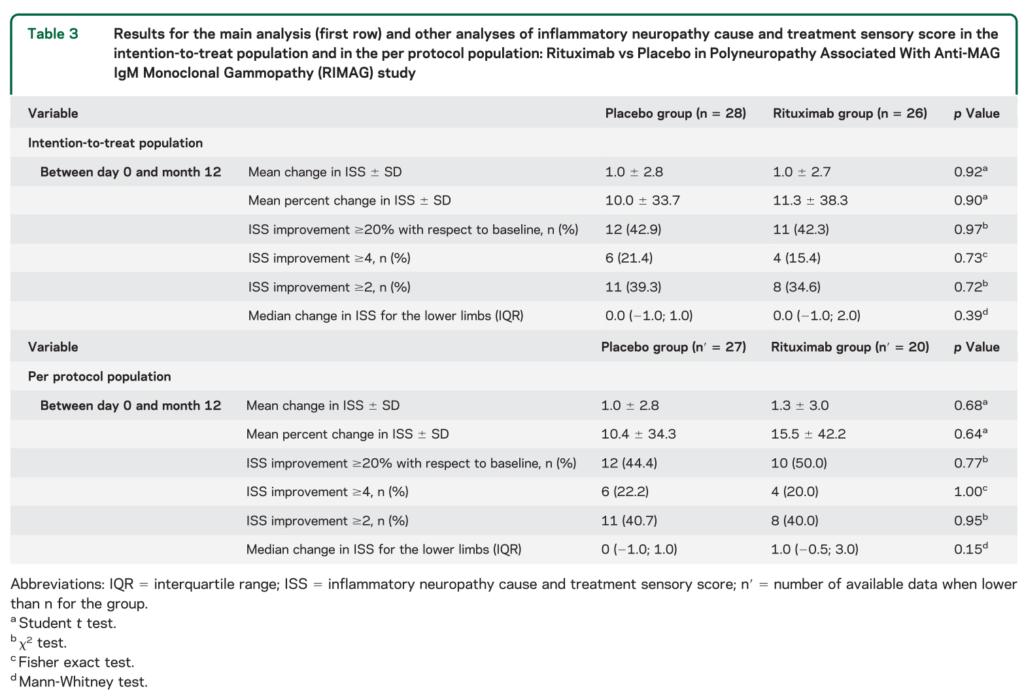
secondary analysisに関してintention to treatではなく”per protocol population”ではINCAT disability scale が2点以上改善する群がリツキシマブ投与群で優位に多い結果でした(p=0.027)。あくまで”per protocol polulation”での解析なので注意です。また副作用に関しては両群で差はありませんでしたが(感染症もなし)、リツキシマブ投与群(n=6/26)でプラセボ投与群(n=1/28)有意に脱落が多い(p=0.047)結果でした。
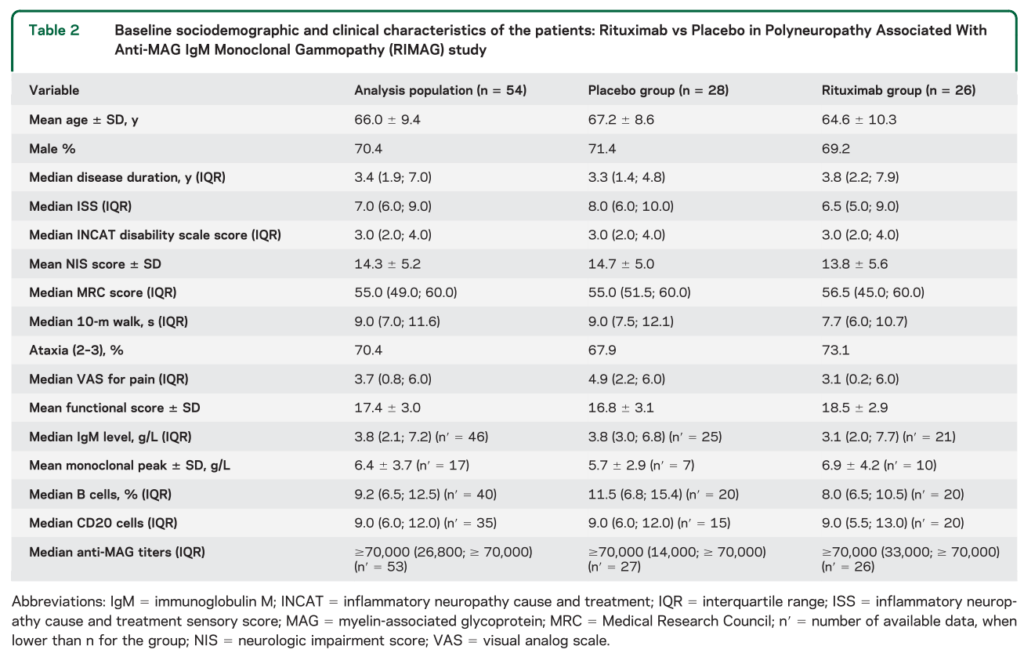
患者背景としては年齢66.0±9.4歳、男性70.4%、罹病期間3.4年、ISS 7.0、10m歩行時間9秒、失調70.4%、MRC55、VAS 3.7、IgM 3.8g/L, B cell 9.2%となっています。以下にまとめを掲載します。
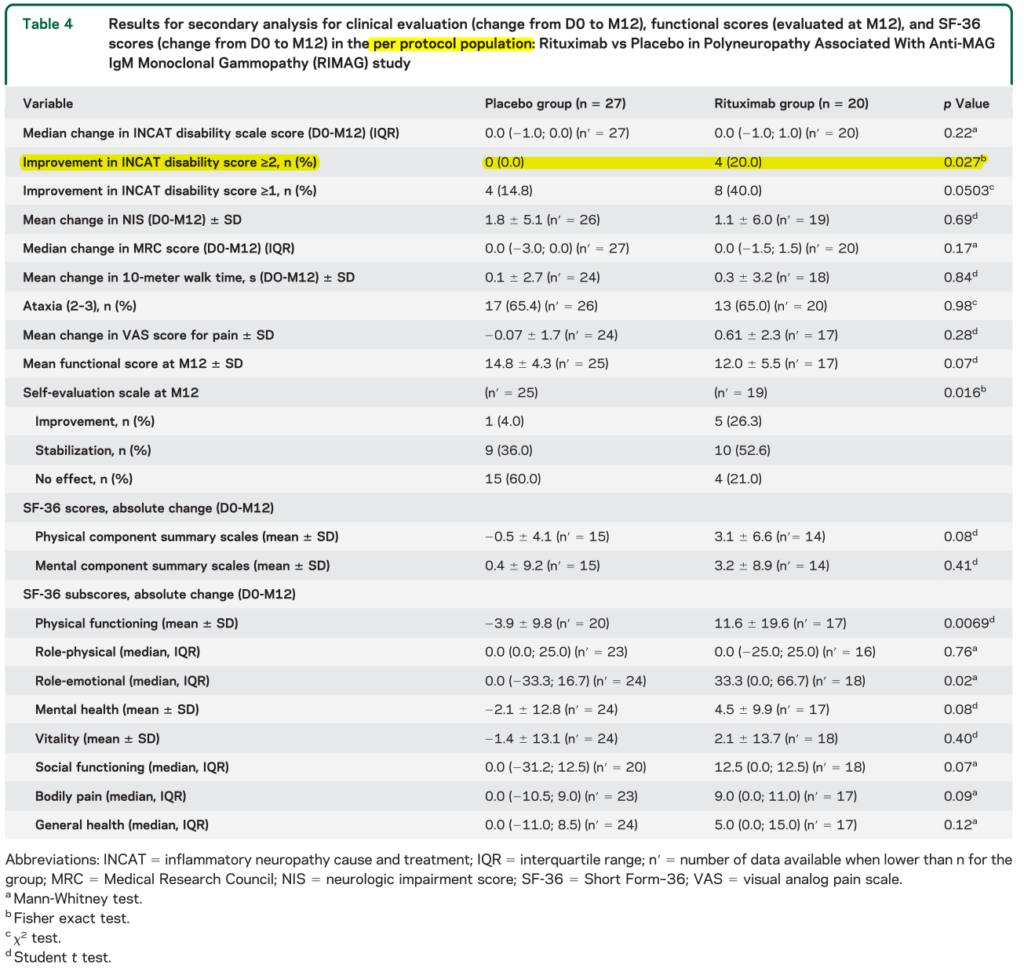
ここでもやはり有用な治療効果判定のメルクマールをうまく設定できていないことが問題として挙げられています。
■リツキシマブの効果を予測する因子はあるか? Journal of the Neurological Sciences 377 (2017) 144–148
4週間のリツキシマブ投与を受けた抗MAG抗体ニューロパチー33例(患者背景:罹病期間8年、20人の患者は6か月以上フォローされ平均42±23か月のフォローアップ、背景疾患は70%MGUS,21%Waldenstorm, 9%:non-Hodgikin lymphoma)をまとめた報告では治療後6か月30%(10/33例)で臨床的改善を認めたとされています(Overall Neuropathy Limitation Scale (ONLS)が1点以上改善で評価)。
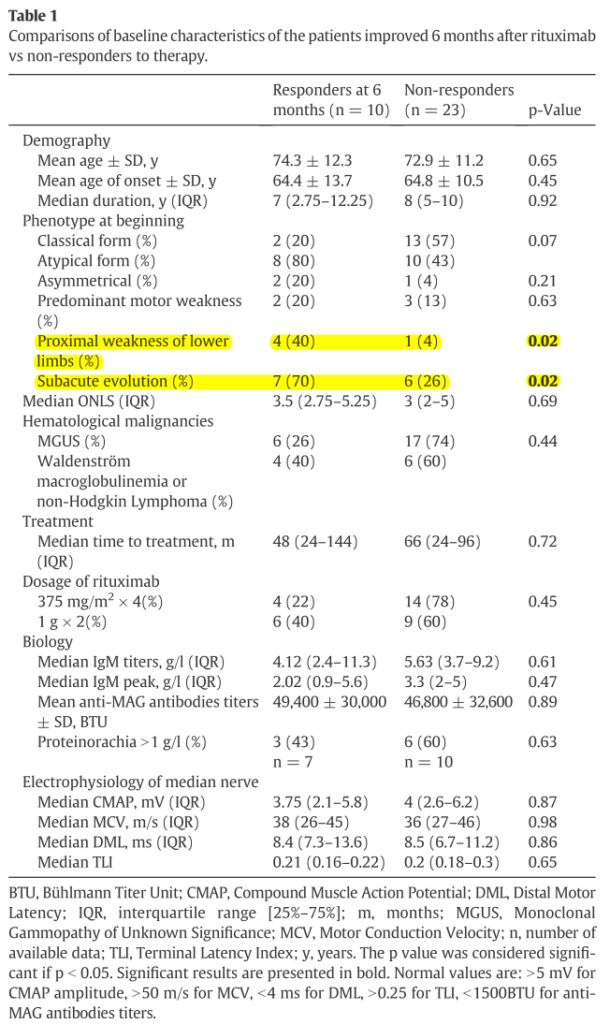
リツキシマブresponder群とリツキシマブnon-responder群を比較した検討では、発症時の下肢近位筋力低下と亜急性の経過の2点がresponder群と相関関係にあることがわかりました(下図参照)。この研究ではMAG抗体価、IgM値、電気生理検査の結果などは相関関係として指摘できませんでした。
逆にリツキシマブに関しては投与により病勢が増悪した報告もありますが(Muscle Nerve 2005; 32: 378–379)、基本的には自然に改善するかIVIG投与によりリバース可能であるとされています。
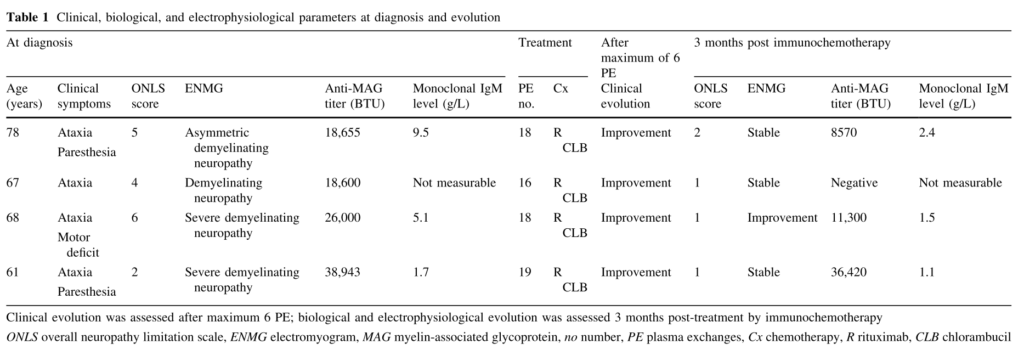
■血漿交換療法が急性増悪に対して効果があった4例の報告 J Neurol (2017) 264:1132–1135
この報告では2006-2016年の間に診療した抗MAG抗体ニューロパチー26例のうち4例が急激な経過で悪化し、それらに対して血漿交換療法を実施したところ4例とも改善を認めたと報告しています(以下に4例をまとめています。特に症例1,2はそれぞれ数日と15日程度で急激に失調が進行して独歩不能となっています)。
PEに関しては既にRCTが行われており(J Neurol Neurosurg Psychiatry 1995; 59:243–247)明らかな有用性は指摘されませんでしたが、このような急激に悪くなる一群に対しては有用である可能性が示唆されます。
以上抗MAG抗体ニューロパチーに関してまとめました。
参考文献
・Curr Treat Options Neurol (2017) 19: 43 治療に関するまとめ