感染性心内膜炎では神経学的合併症を20~40%合併するとされています。塞栓による脳梗塞、感染性動脈瘤、動脈瘤破綻による脳出血、くも膜下出血などが代表的な神経学的合併症です。ここではよく神経内科医が感染性心内膜炎に関してコンサルテーションを受ける点や疑問点をまとめて、現状解答できる内容を解説していきます。
神経学的合併症のリスクは何か?
塞栓症合併症リスクに関しては、様々な報告がありますが最大公約数としてまとめると下記がリスクとして挙げられます。
・疣贅の大きさ>10mm
・疣贅の部位:僧房弁(特に前尖)
・疣贅の可動性:あり
・起炎菌:S.aureus
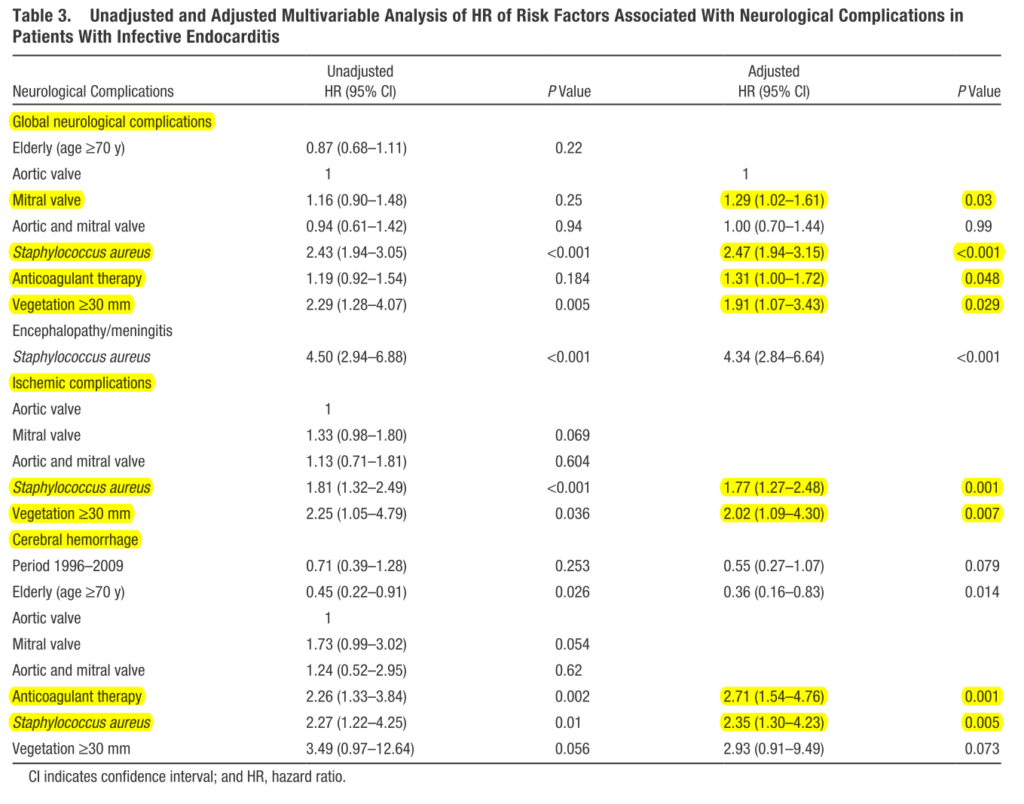
スペインの左心系IE1345例を後ろ向きに解析した研究では、脳梗塞は14%、脳出血は4%に合併したとされています。疣贅の大きさ3cm以上(adjusted HR 1.91)、起炎菌S.aureus(adjusted HR 2.47)、抗凝固療法(adjusted HR 1.31)、僧房弁(adjusted HR 1.29)が独立したリスク因子でした(Circulation 2013;127:2284)。抗凝固療法は神経学的合併症(adjusted HR 1.31 P=0.048)、脳出血(adjusted HR 2.71 P=0.001)のそれぞれ独立したリスクでした。この研究では生命予後不良因子は頭蓋内出血と中等度以上の脳梗塞のみで、軽症脳梗塞や無症候性脳梗塞が生命予後にどこまで影響を与えるかは明らかではありません。
抗凝固療法はIEによる脳梗塞を予防できるか?
IE患者さんに対する抗凝固療法とプラセボによる脳梗塞予防を調べたRCTは1つもありません。上記の1345例の後ろ向き研究でも抗凝固療法による脳梗塞予防効果は示唆されず、その他の観察研究でも抗凝固療法による脳梗塞予防効果を積極的に支持する結果には乏し現状です。メリットが明確でないですが、抗凝固療法による出血合併症は増加するため(頭蓋内出血も含む)このためIE患者の脳塞栓症予防目的に抗凝固療法は実施しない方針をとります。特に既に脳梗塞を合併している場合は出血性梗塞リスクがあるため、抗凝固療法は実施しません。ただ、人工弁患者さんの場合は個別に対応が必要なことと心房細動合併例でも抗凝固療法の有無を総合的に判断が必要です。
IE患者さんに対するアスピリン投与とプラセボを比較したRCTは1つ存在しますが(J AM Coll Cardiol 2003;42:775)、感染性心内膜炎患者115人に対してアスピリン325mg/日群とプラセボ群に分けて検討した結果、塞栓症は28.3% vs 20.0%(有意差なし)とアスピリン投与により抑制することは出来ない結果でした。データは少ないですが、抗血小板薬によるIE患者での塞栓症予防効果はないと考えられます。
感染性心内膜炎に特徴的な画像所見は何か?
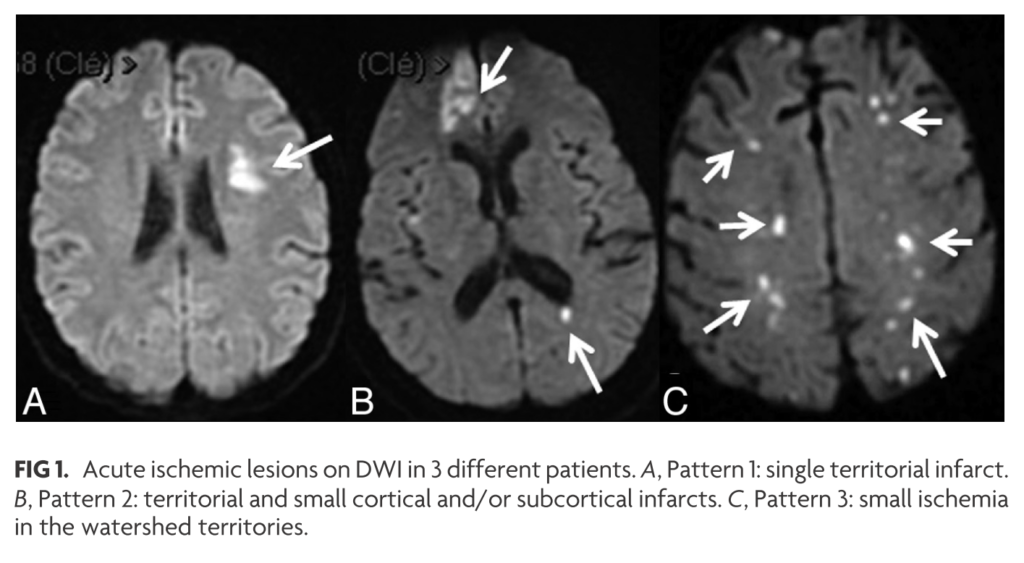
■脳梗塞の分布
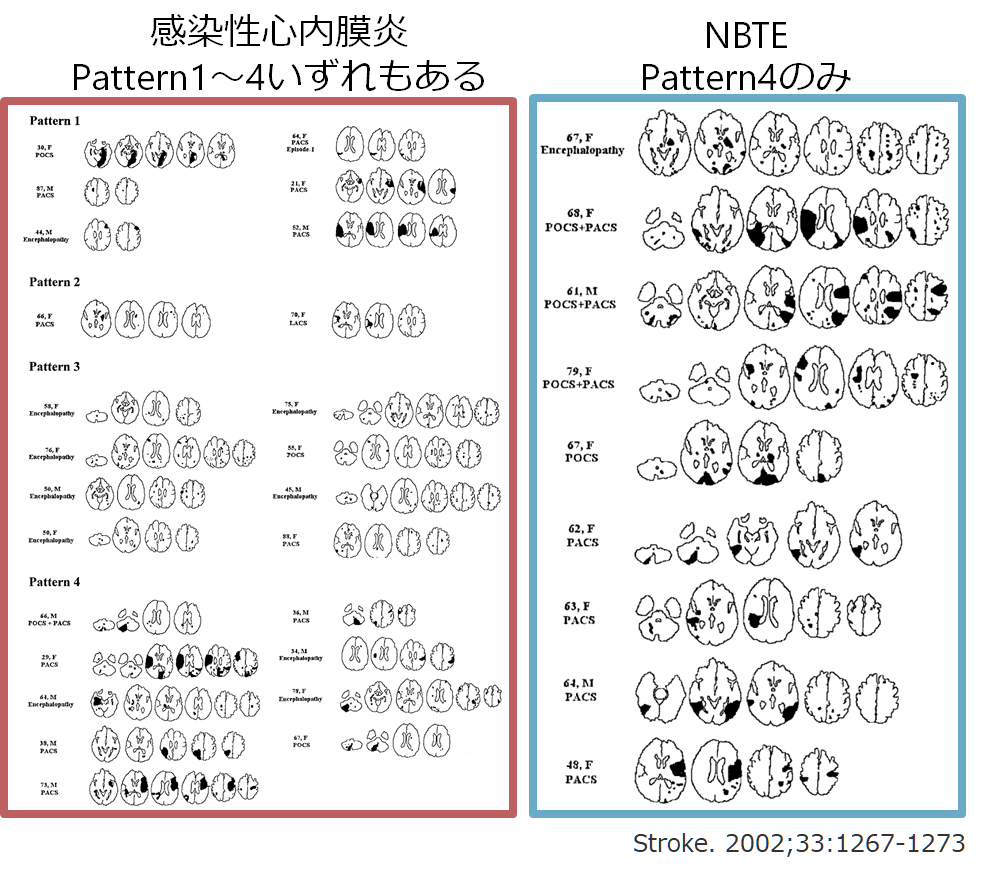
感染性心内膜炎とNBTEの画像上の違いを検討した論文(Stroke. 2002;33:1267-1273)では、感染性心内膜炎27例、NBTE9例を比較し、病変の分布を以下の4パターンに分類しています。
(1) single lesion
(2) territorial infarction
(3) disseminated punctate lesions
(4) numerous small ( 10 mm) and medium (10 to 30 mm) or large( 30 mm) lesions in multiple territories
感染性心内膜炎はpattern1~4いずれもありますが、NBTEはpattern4のみであったと報告されております(下図)。NBTEは大小さまざまな大きさの梗塞域が複数の領域に分布するのに対して、感染性心内膜炎では様々な画像パターンがあることが示唆されます。
■円蓋部くも膜下出血
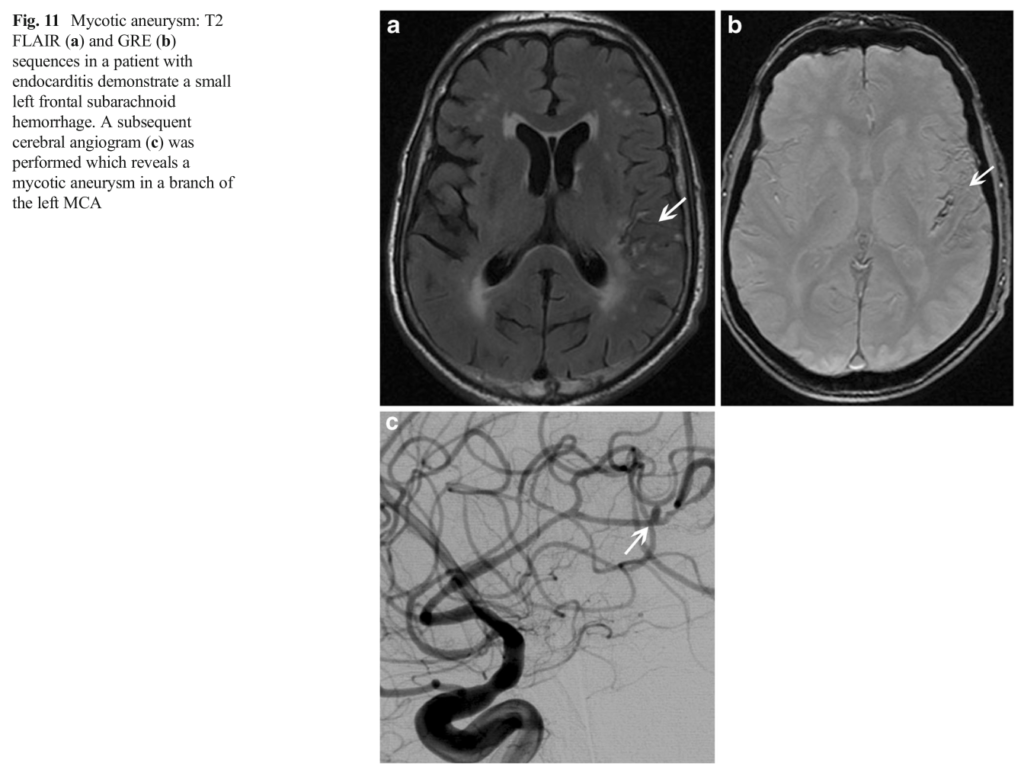
感染性心内膜炎で形成される感染性動脈瘤はWillis動脈輪部分ではなく末梢部分に形成されることが多いので、動脈瘤が破綻すると一般的な脳底部のくも膜下出血ではなく、円蓋部くも膜下出血を呈します。個人的には「円蓋部くも膜下出血に発熱を伴っているは感染性心内膜炎を疑う」というルールを決めています。円蓋部くも膜下出血は一般的な脳底部くも膜下出血と異なり、外傷性が圧倒的に原因として多いですが、外傷性以外はRCVS、CAA、感染性心内膜炎、脳静脈洞血栓症など鑑別がかなり絞られることが特徴です(下図引用:Emerg Radiol (2015) 22:181 – 195)。軽微な所見ですが見逃さないようにしたいです。円蓋部くも膜下出血に関してはこちらにまとめがありますので、ご参照ください。
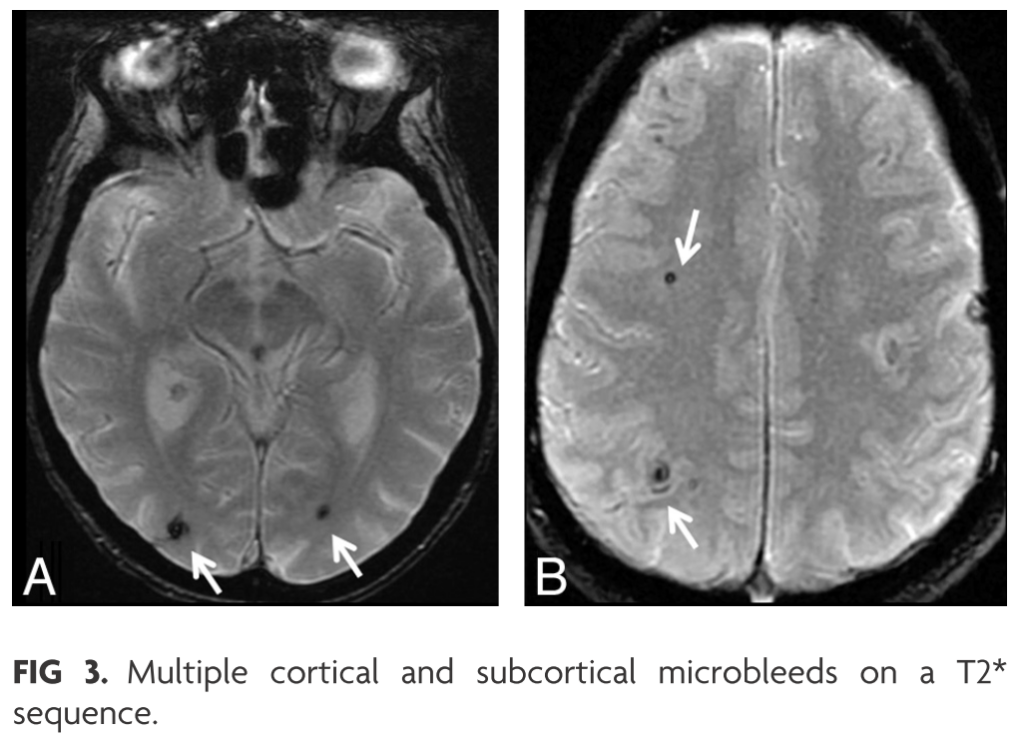
神経学的に無症候であっても画像上脳血管障害はあるか?
109人の神経学的無症候のIE患者を調べた研究では、71.5%にMRI異常所見を認めました(AJNR 2013;34:1579)。内訳としては、虚血病変:37% (watershed area:62.5%, 時相がずれている病変:52.5%)、微小出血:57% (皮質:67% superficialに多くcortico-pial junctionでのBBB破綻が機序として考えられる)、SAH:7%、cortical hemorrhage:3%、microabscess:3%となっていました。
撮像方法はDWI、FLAIR、T2*(もしくはSWI)、MRAが推奨されます。T2*が使用されるようになってから微小出血の検出感度が向上し、昔の報告よりも実際には多くの微小出血合併例があることが分かるようになってきました。動脈瘤は微小なのでMRAの空間分解能では検出できない場合も多いため、通常のMRAで動脈瘤がないからといって微小動脈瘤形成が無い訳ではありません。
感染性心内膜炎でMRIは全例必要か?
神経学的所見がある場合はもちろん頭部MRI検査を実施しますが、問題なのは神経学的所見に異常がない場合でもIE患者で頭部MRI検査をするべきか?という点です。実際に上記に様に無症候であっても画像上異常所見は多く検出されることが分かっています。ではこの所見を臨床上どのように活かせば良いでしょうか?
・診断:MRIで塞栓所見があればDuke criteriaの小基準を1つかせげる
・治療:微小出血がある場合抗凝固療法を中止する根拠になる・抗菌薬の髄液移行性の問題
実際IE患者で早期にMRIを撮像することで、その前後で診断やマネージメントに影響があったかどうか?を検討した研究では32%において診断がdefinite or possibleへ上がり、18%で治療方針への影響があったとされています(Ann Intern Med 2010;152:497)。この結果から分かるように早期MRI検査が実際に診断、マネージメントに影響が十分出るため、たとえ神経学的所見を伴っていない場合も早期に頭部MRI検査を実施するべきと個人的には考えています。
急性期血栓溶解療法 rt-PA
出血性梗塞助長のリスクが高いため感染性心内膜炎による脳梗塞に対してのrt-PA療法は禁忌です。アメリカの入院患者データからrt-PAを投与された脳梗塞患者をIE患者222人とIE以外134048人に分けて後ろ向きに解析したところ、頭蓋内出血はIE群 20% vs 非IE群6.5%(P=0.006)、予後良好はIE群 10% vs 非IE群 37%(P=0.01)とIIE群で頭蓋内出血、予後共に悪い結果だった報告があります(Stroke 2013;44:2917)。
脳血管障害合併例は抗菌薬の髄液移行性を考慮するべきか?
明らかなに脳膿瘍を合併している場合、細菌性髄膜炎を合併している場合はもちろん髄液移行性の高い抗菌薬を投与します。しかし、実臨床で悩むのは無症候性で画像上脳血管障害を合併している場合に髄液移行性を考慮した抗菌薬選択をするか?という点です。
「脳出血しているならBBBが破綻しているはずだから髄液移行性は悪くても問題ない?」と何となくぼーっと考えてしまいますが、実際には分かりません。特に問題になるのがMSSAによる感染性心内膜炎のケースで、セファゾリンでずっと治療していて後から脳膿瘍を形成してこないか?(セファゾリンは髄液移行性が低いため)というシナリオです。S.aureusは中枢神経合併症頻度が他の菌よりも多いです。実際にセファゾリンだけで治療していて、無症候性に脳膿瘍を形成していた場合を経験することが稀にあります。
私は脳梗塞、脳出血合併例では髄液移行性の良い抗菌薬を使用し、無症候性の場合はその都度相談という形にしています。画像上も問題ない場合は髄液移行性は考慮していません。この点に関して私が調べた限り答えになるデータはなかったのですが、是非ご意見いただけますと幸いです。やはり海外にはnafcillin, oxacillinがあるのでそもそもこのような臨床問題をかかえていないんですよね・・・・(日本人だけの悩み?)。
私は中枢神経病変を合併している場合は、第3世代セフェムのセフトリアキソンもしくは第4世代セフェムのセフェピムを使用するようにしています(セフェピムは確かにGPCに対しても優れている抗菌薬ですが、セフェピム脳症の頻度も多く、中枢神経病変がある時に使用するのに躊躇があるかもしれません)。
セフトリアキソンを使用する際の懸念点としては、MSSA菌血症に対してセフトリアキソンとセファゾリンを比較した後ろ向き研究でセフトリアキソン群(n=33)の方がセファゾリン群(n=38)と比べて治療失敗が多い(54.5% vs 28.9%; P=0.029)報告があることです(Forum Infect Dis. 2018 May 18;5(5):ofy089.doi: 10.1093 前向き研究はありません)。しかし、現状は仕方ないのかなと思います。本当に日本では髄液移行性のある抗黄色ブドウ球菌抗菌薬が無い点が悩ましいです。
いつ手術をするのが良いのか?
感染性心内膜炎の手術の適応は1:心不全合併、2:感染コントロール不良、3:塞栓症予防が挙げられます。神経学的に問題となるのは3番目の塞栓症予防の観点です。
いつ手術するべきか?に関して唯一RCTとして存在するのは2012年NEJMから発表された”EASE study”です。感染性心内膜炎(塞栓症高リスク患者:自然弁、疣贅大きさ10mm以上)において早期手術介入は塞栓症発生を有意に軽減する(死亡に関しては有意差なし)ことが示唆されました。注意点としては、背景因子として起炎菌としてS.aureusが少ない、若年で周術期riskが低い患者が多く、周術期riskが高い患者にそのまま適応することは出来ないかもしれないといった点が挙げられます。
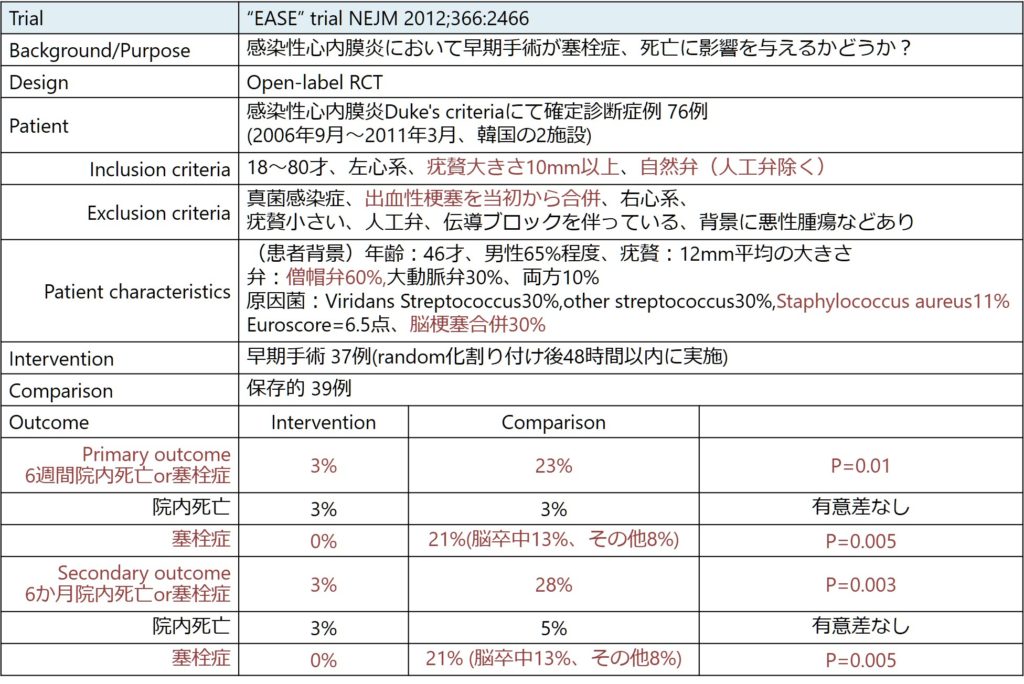
この結果から自己弁(大動脈弁、僧房弁)で10mm以上の疣贅を有する感染性心内膜炎患者さんは塞栓症予防目的に積極的手術適応となります。しかし、前向きの大規模臨床試験はこれしか存在せず、現状はこのinclusion criteriaに該当しない患者さんにいつ手術適応とするか?は施設ごとの判断にゆだねられている現状と思います。
脳血管障害合併例での手術適応は?
心臓血管外科手術では体外循環をまわる際に抗凝固薬(ヘパリン)を使用するため、脳血管障害を悪化させる可能性が懸念材料になります。脳出血合併、昏睡、中等度以上の脳梗塞合併例以外では適応があれば手術を延長するべきではないとされています。
感染性心内膜炎102人の手術による脳梗塞の出血転化(hemorrhagic transformation)のリスクに関しての後ろ向き研究では(日本から Ann Thorac Surg 2012;94:489)、早期手術、後期手術いずれでも出血転化リスクは非常に低く、手術介入を遅らせるべきではないと結論づけています。データが少なく判断が難しいですが、少なくとも脳梗塞合併例全例で手術を延期する出来ではないのではないかと考えます。
脳出血合併例では日本のガイドラインでは4週間待機を提案されています。実際どこまで延期できるのか?というのは非常に難しい問題で答えはありません。ここではMRIで認める微小出血は含まれていない点に注意が必要です。
実際に手術に関しては施設ごとに相当アプローチに違いがあると思います。手術するかどうかに関して最終的な主導権はもちろん手術をしてくださる心臓血管外科の先生方にありますが、感染症科、神経内科からも助言が出来る体制を構築しておく必要性があることに変わりはないと思います。
参考文献
・Current Treatment Options in Neurology 2013;15:465 IEでの神経合併症review
・日本循環器学会 感染性心内膜炎ガイドライン 2017年