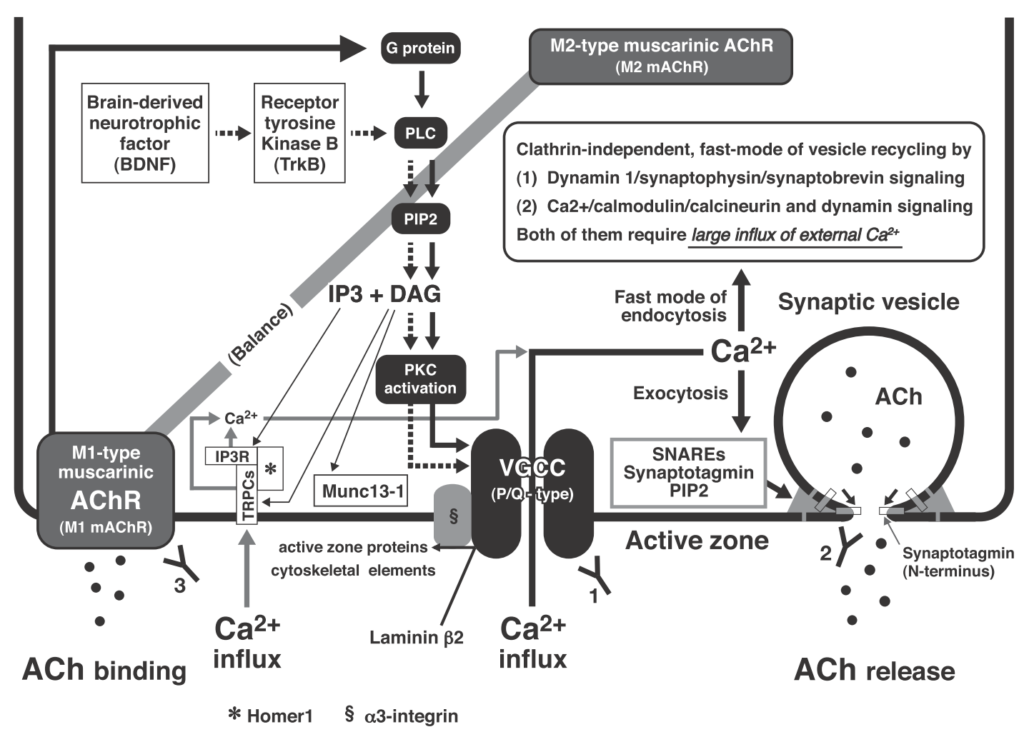
病態
VGCC P/Q-type 抗体(電位依存性カルシウムチャネル)が関与しており、傍腫瘍性の自己免疫疾患とされています(必ずしも腫瘍を合併しない場合もあります)。神経終末のVGCCに対する抗体によってdown regulationし、Caイオンが流入せず、神経終末からのAch放出が低下→筋無力症状が出現します。(下図Ann. N.Y. Acad. Sci. ISSN 0077-8923より参照)
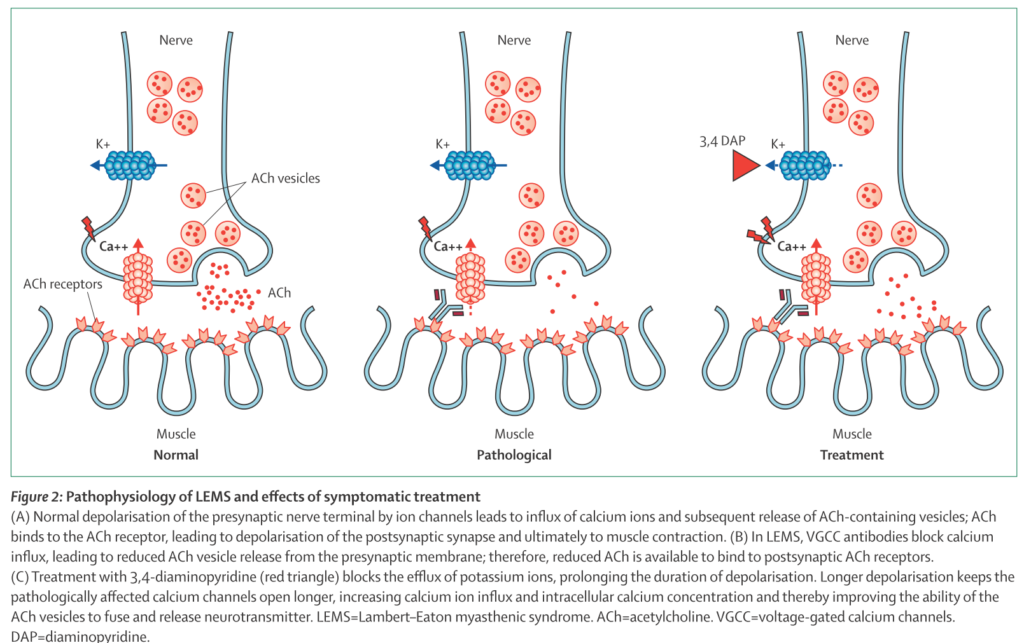
原因
・肺小細胞癌SCLC(small-cell lung cancer):50-60%
・非腫瘍合併:NT(non-tumor)-LEMS
*SCLC以外の腫瘍合併も報告あり:乳癌、前立腺癌、胃癌、直腸がん、リンパ腫
1953年 Anderson 47才男性 近位筋力低下、嚥下障害、深部腱反射消失が最初の報告
10%未満に亜急性小脳運動失調を合併:PCD-LEMS
SCLCはLEMS合併例の方がLEMS非合併例と比べて予後が良いことが指摘されており、これはLEMS合併例では腫瘍の早期発見につながるためと考えられています(J Clin Oncol 2008; 26: 4276)。
*LEMSが先行する場合が多く、悪性腫瘍検索はLEMS発症後2年間は繰り返すべきで、数か月おきに画像検索などで評価するべき(推奨提示1C ガイドライン2022)
疫学
発症年齢は50歳台(日本からの報告では中央値62才)、男女比:3:1、SCLC合併は61%と報告されています(日本での110例報告より)。全体的な頻度は重症筋無力症(以下MGと略記します)の1/100程度とMGと比べると比較的稀な疾患です。*2017年本邦受診のLEMS患者は348人(ガイドライン2022より)
臨床症状
1:近位筋筋力低下
下肢近位筋筋力低下が特徴的イスから立ち上がりにくくなった、階段を登れなくなった。筋委縮を認める場合も多いです。筋力低下の分布は下肢→上肢、近位→遠位という進展をとることが特徴です。
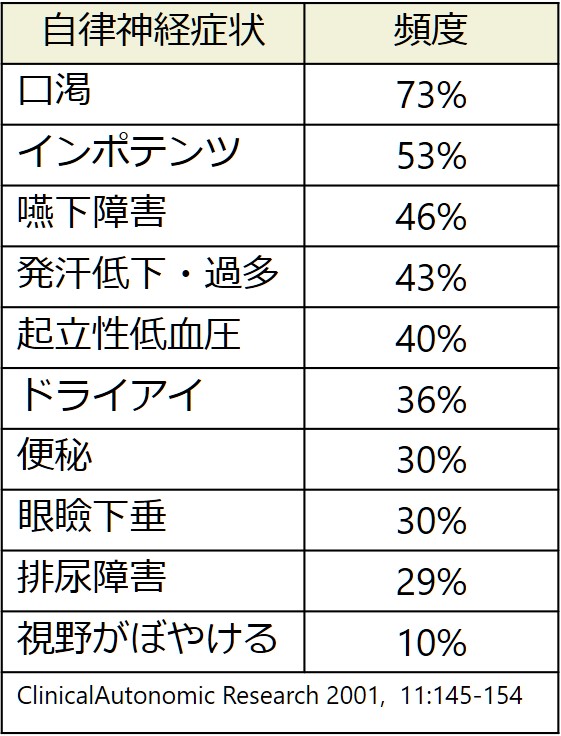
2:自律神経障害37-80%
口渇(最多)→便秘→発汗欧米での方が頻度が多いです。筋力症状に先行する場合もあります。LEMSの自律神経症状をまとめた報告では3~6%では自律神経症状が筋力低下に先行するとされています(ClinicalAutonomic Research 2001, 11:145-154)。
3:深部腱反射消失減弱
・近位筋筋力低下は筋疾患やMGに多いですが、通常どちらも深部腱反射は保たれます。その点で近位筋筋力低下+深部腱反射消失はLEMSを疑う重要なヒントとなります。
・強収縮後に腱反射が復活する“post-exercise facilitation”が特徴的・特異的な所見(40%に認めるとされます)です(一度見ると感動します)。以下は自験例で上腕二頭筋の深部腱反射が最初は消失していますが、強収縮後に回復する所見です。
収縮後の一時的な筋力回復が有名な所見ですが、これを病歴上で拾い上げることは通常困難です。
下肢近位筋からの障害が目立つため筋症を当初疑いたくなりますが、腱反射が著明に低下していたり、神経原性を疑うような萎縮を認めることから「ぱっと」診断を早期しづらい難しさがあります。
初発症状 四肢が多い(MGは球麻痺、外眼筋麻痺が多いことに比べて)
初発症状内訳:下肢筋力低下60%・全身脱力18%・筋痛5%・dry mouth 5%・上肢筋力低下 4%・複視4%・構音障害 2%
以下に既報の神経症状、自律神経症状をまとめます。
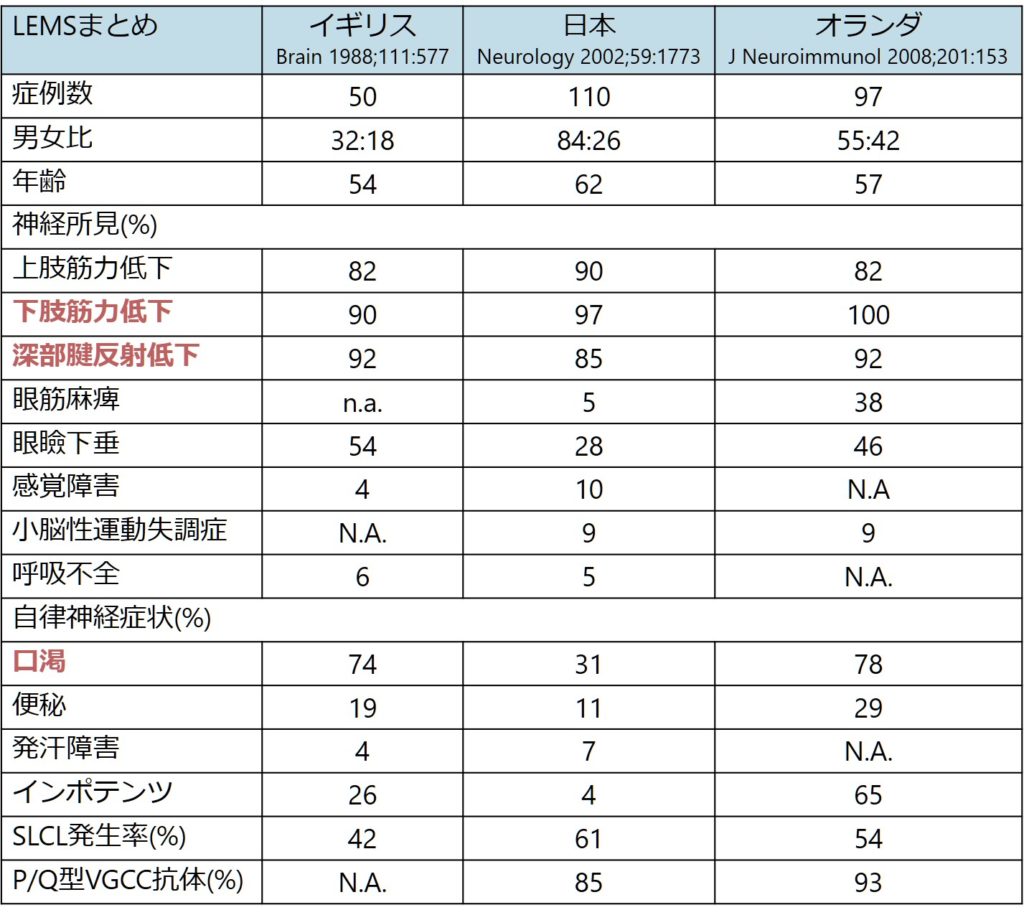
LEMSとMGの臨床上の違い
LEMSとMGは臨床的に区別が難しい場合がありますが、障害される筋の分布に違いがあるかどうかを調べた論文があります(LEMS38人、MG108人)。
初発症状
・MG 59%:眼筋 29%:球症状 12%:四肢
・LEMS 0%:眼筋 5%:球症状 95%:四肢
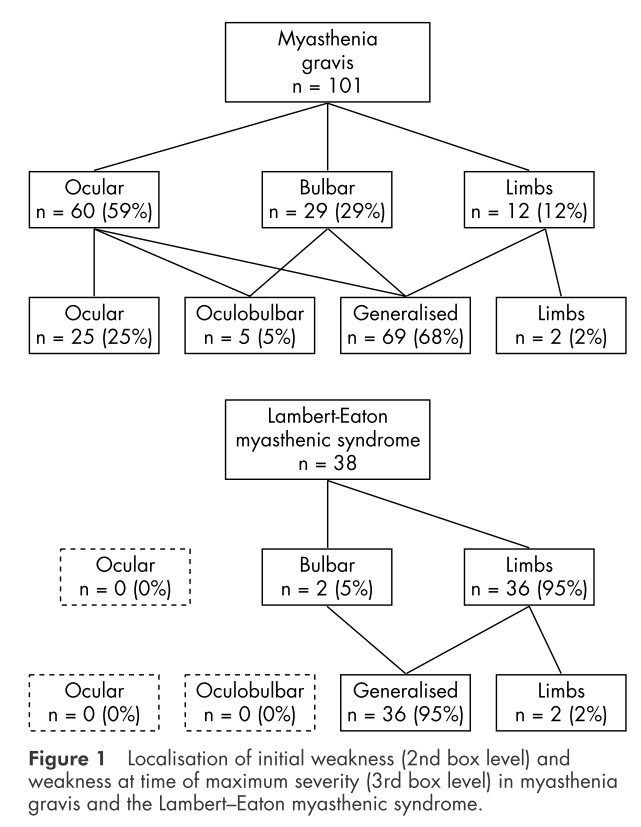
上図で2段目は初発症状、3段目は最重症時の症状を表していますが、やはり眼筋だけに限局しているLEMS症例は認められません。この論文ではMGは”craniocaudal direction”(つまり頭頸部→四肢)、LEMSは”opposite direction”(つまり四肢→頭頸部)という順番で筋肉が障害される特徴があることが指摘されています。
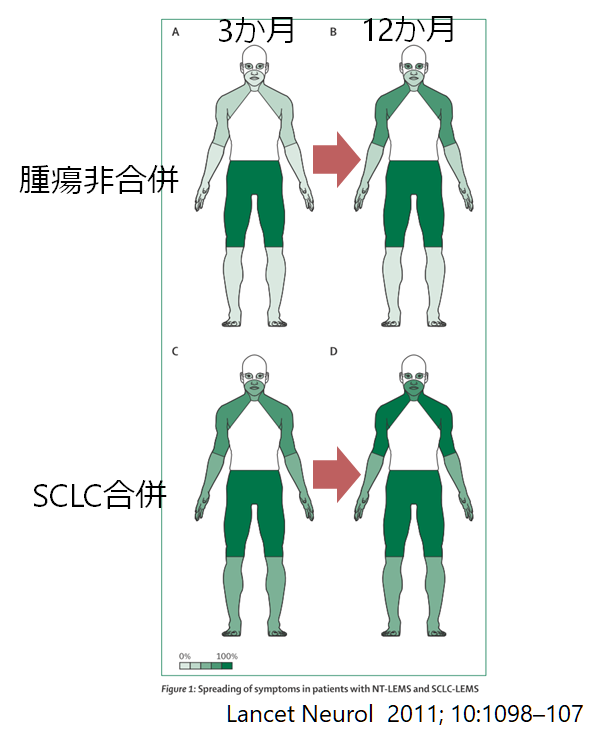
診断の難しさ
LEMSの診断は難しいです。正確にいうとLEMSは最初から疑う事が難しい疾患です。症状発症から診断までの期間(中央値)はSCLC-LEMSで4か月、NT-LEMSで12ヶ月・19ヶ月と報告されており、特に腫瘍非合併の場合は診断までに相当時間がかかっていることがわかります。また58%の症例では当初別の診断であったと報告されています(J Clin Oncol 2011; 29: 902–08)。
LEMSはMGの様な特異的な病歴を有する訳ではありません。また神経所見も下肢近位筋筋力低下、深部腱反射低下・消失、自律神経障害とそれぞれ単独では特異的な所見ではないです。電気生理検査をすればすぐに分かりますが、これも通常強収縮後のCMAP ampの増強はルーチンでは普通検査しないので事前に病歴・神経所見から疑う必要があります。普通に診療をしていて患者さんが診断を教えてくれるような病気ではなく(MGは比較的患者さんが病気を教えてくれますが)、医療者が常にLEMS疑う姿勢が求められます。
まずLEMSの診断は難しいことを認識して、臨床的に疑う閾値を下げ、下肢近位筋筋力低下、深部腱反射低下・消失、自律神経障害の組み合わせから疑う、myopathy, neuropathyとしてもしっくりこない場合も疑う、MGのと思っても一度LEMSの可能性を疑うという姿勢が重要と思います。
鑑別(逆に下記の疾患を疑った場合はLEMSを疑う)
・封入体筋炎:大腿四頭筋の筋力低下・萎縮からmyopathyが鑑別に挙がります。LEMSでは通常CK上昇は認めません(封入体筋炎もCKはそこまで高値にならないですが)。
・運動ニューロン疾患:これも萎縮が目立ち、深部腱反射低下から下位運動ニューロン障害を想起すると鑑別になります。通常自律神経障害は合併しないのでここはLEMSとの違いで重要です。
・ギランバレー症候群:亜急性の経過でくると鑑別になります。LEMSでは通常感覚障害や痛みを訴える場合はまれで、髄液も蛋白上昇を認めない場合が多いです。
検査
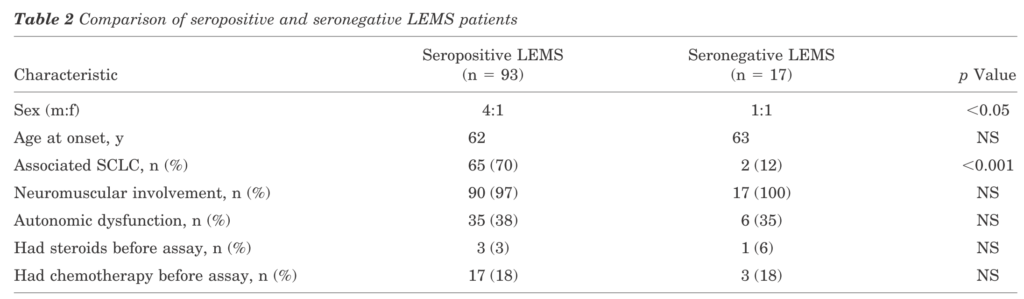
採血:VGCC P/Q型抗体 日本の110例の報告ではVGCC抗体陽性例は全体の85%(n=93)で、陽性例でのSCLC合併が70%、VGCC抗体陰性例(n=17 15%)ではSCLC合併が12%(p<0.001)と報告されています。VGCC抗体陽性例と陰性例で年齢、自律神経障害の合併などの差は認めていません。
神経伝導速度検査 + RNST:
・通常のNCSでCMAP ampは小さいことが特徴で、通常SNAPは問題ありません。「MMTでは筋力5でとれるにも関わらずCMAP ampが小さい場合はLEMSを疑う」という重要なpearlを先日教えていただき、この重要性を痛感しております。MMTはNCSでの単発刺激ではなく筋収縮が持続して起こっている状況での筋力であり、NCSでのCMAP ampはあくまで蛋白刺激を反映しているためにこの現象が起こります。
・強収縮後や高頻度刺激後はCMAP ampがbaselineよりも2~6倍増高することが特徴的かつ診断的です(CMAP amp 60%増高というcut offでも特異度が十分保たれるという報告もあります(感度97%, 特異度99%Muscle Nerve 2005; 32: 515–20)。強収縮の時間は通常10秒で十分とされています(Muscle Nerve 37: 572–575, 2008)。下図は自験例のNCS強収縮前後でのCMAP amp比較です。
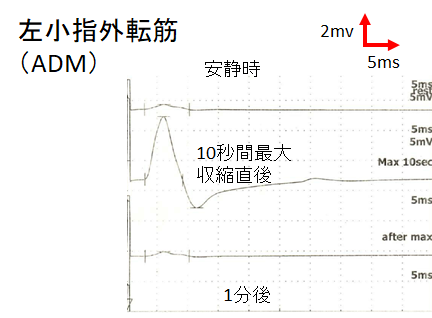
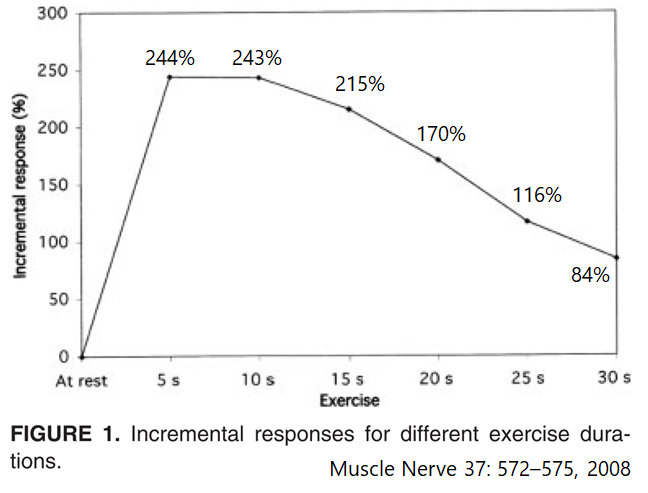
強収縮の時間とbaselineからのCMAP amp増大%をグラフにしたものが下図になります。強収縮時間5秒で244%、10秒で233%の上昇を認めますが、30秒では84%と低下してきてしまうことがわかります。Muscle Nerve 37: 572–575, 2008
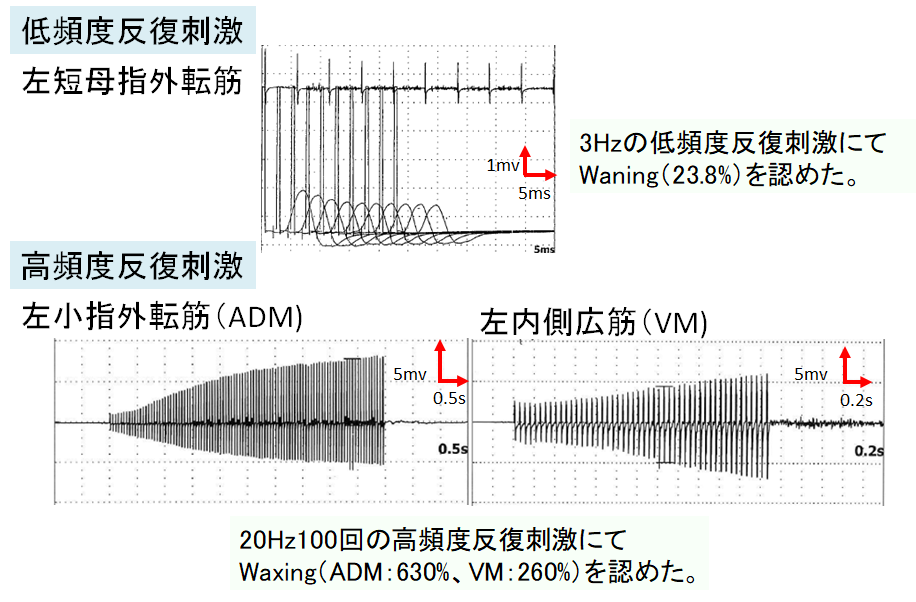
・低頻度反復刺激ではwaningを認め(MGで認める様なJ-shapeではなく、10発目まで連続的にampが低下していく波形になります。RNSTに関してはこちらに詳しくまとめましたのでご参照ください)、高頻度反復刺激ではwaxingを認めます。高頻度反復刺激は患者さんにかなりの疼痛を伴うため、上記の強収縮前後のCMAP amp比較がdiagnosticであれば通常必要ありません。参考までに自験例の低頻度反復刺激と高頻度反復刺激例を掲載します。
・ちなみに重症筋無力症の診断で用いるテンシロンテストはLEMSでも症状が一時的に改善するため注意が必要です。
*参考:ガイドライン2022での電気生理基準
・1発目のCMAPamp低下
・低頻度刺激で10%以上の漸減現象
・高頻度刺激または10秒間の最大随意収縮後に60%以上のCMAP振幅漸増現象 *ここでは60%が採用されています
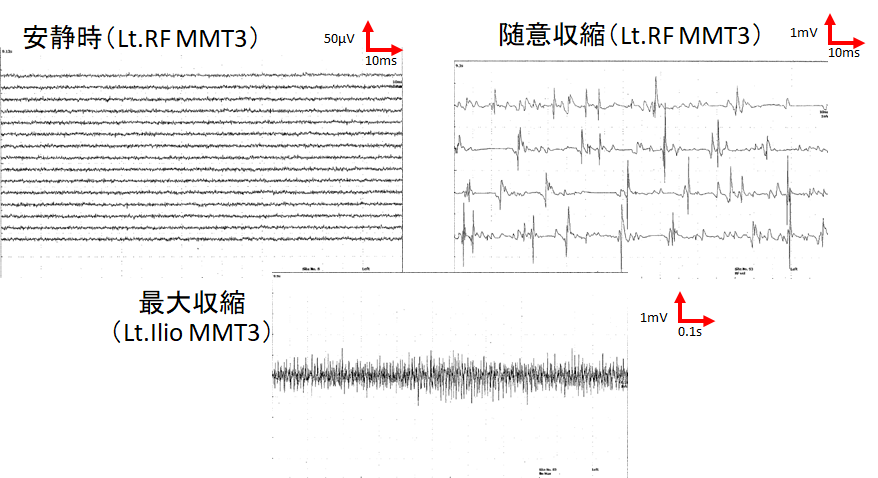
・針筋電図検査では通常low amplitude, polyphasic MUPを認め、筋原性変化の所見を認めます。LEMSでは病態としてはAch放出が妨げられるため、終板電位が小さくなり、一部の筋線維で活動電位を発生する閾値に達せず神経筋伝達が行われなくなります。すると機能的なconduction blockとなることでMUPの振幅は低下し、polyphasicになります。このため一見筋原性変化と同じようなMUPの形態になるというわけです。以下が自験例です。
Saxon試験:自律神経障害としての唾液量減少を検出するために実施を検討します。2分間ガーゼを口に含んで咀嚼して浸みこまれた唾液の重さを計測します(2分間で4g以上が正常です)。
造影CT検査(もしくはPETCT):腫瘍検索目的
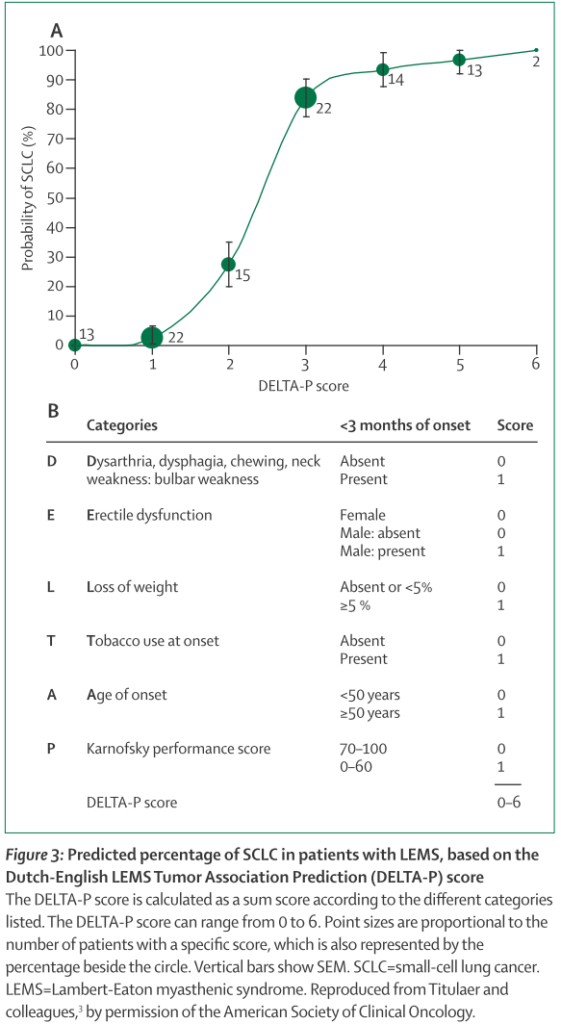
LEMSが肺小細胞癌に先行することもあり、肺小細胞癌が遅れて検出される場合もあります(日本からの報告では神経症状が腫瘍に先行するのが84%)。ほとんどは1年以内に発見され、2年以降に発見されることは稀とされています。LEMSでの肺小細胞癌発症関連因子を調べたDELTA-P scoreというものがあり、自律神経障害の有無、球症状の有無、体重減少、発症時の喫煙歴、年齢、Karnofsky performance scoreを点数化して3点以上では肺小細胞癌の可能性が高くなるとされています(下図)。
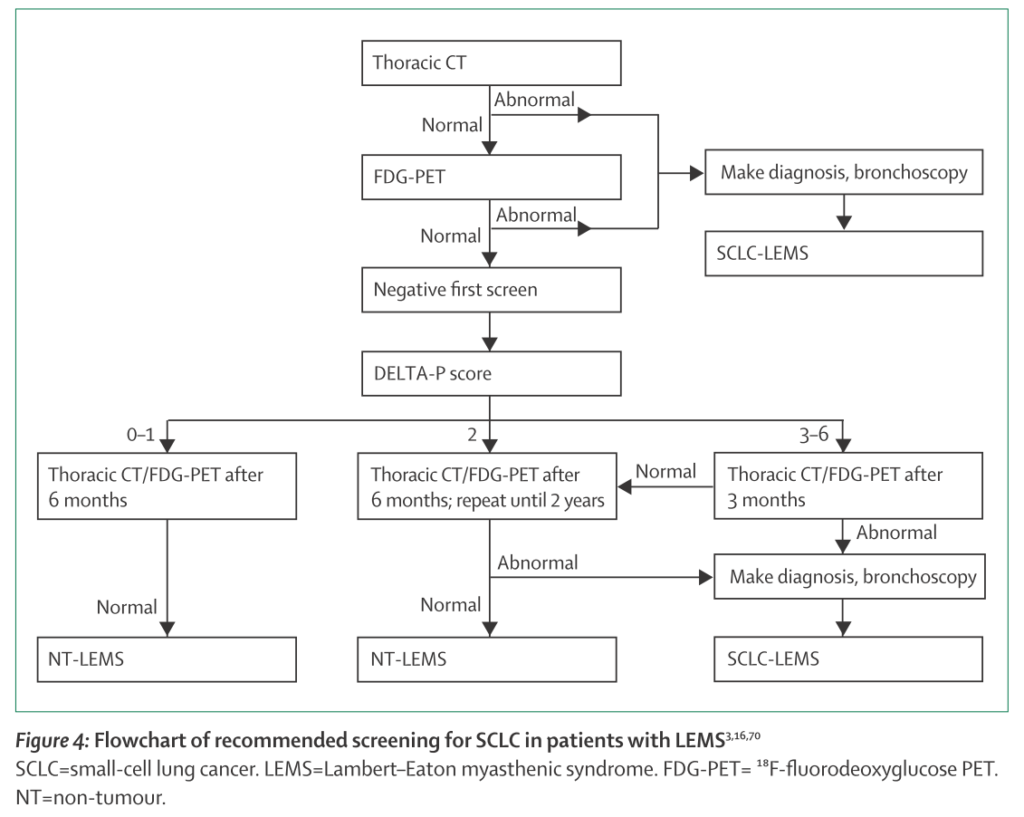
腫瘍のスクリーニング方法としては下記のアルゴリズムがあります。
治療
治療原則:悪性腫瘍の早期発見とその治療
悪性腫瘍合併例:腫瘍の治療を優先し、これが何よりも神経症状の治療になります。
3,4-DAP(3,4-ジアミノピリジン):電位依存性Kチャネルを阻害し、脱分極を維持することで電位依存性Caチャネルをより開くことでCaを流入させ、シナプス間隙のAChを増やす作用がある薬剤です。日本では使用が制限されているためハードルがあります(倫理委員会で通す必要がある)。
*コリンエステラーゼ阻害薬:症例報告レベルでは効果があったという報告もあり検討してもよいかもしれない
免疫治療:重症例では血漿交換療法、免疫グロブリン投与の実施を検討します。長期管理ではステロイド+ステロイドsparingの薬剤(アザチオプリンなど)が必要となる場合が多いとされています。しかし、なかなか治療抵抗性が高い場合が多いです。
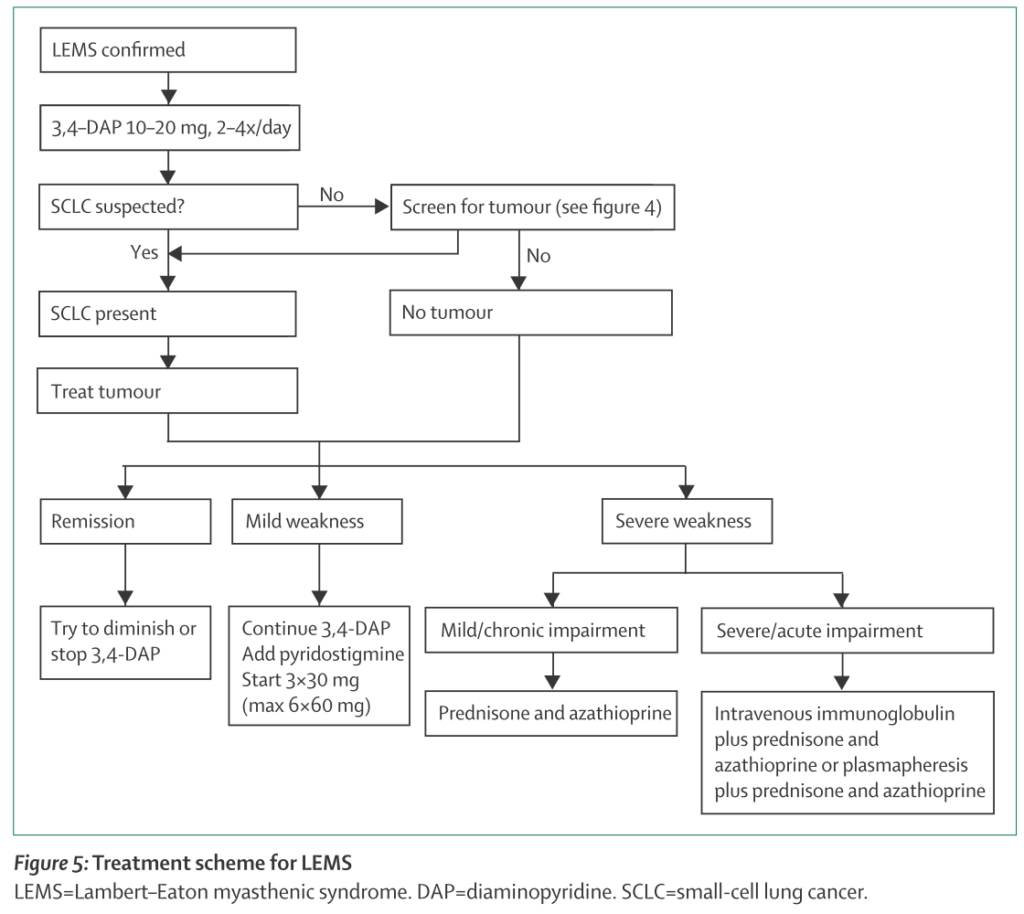
*上図はNewsom-Davisが1998年に提唱した治療アルゴリズムを踏襲し発展
LEMS症例を経験したため、まとめさせていただきました。まだまだ経験が少なく、臨床的にどう疑うか?などコメントいただけますと幸いです。治療に関してまだ調べが不十分なので今後up dateしていければと思っております。
参考文献
・Lancet Neurol 2011; 10:1098–107:LEMSに関しての包括的reviewで、ほとんどの内容をこちらから引用させていただきました。
・Neurology 2002;59:1773:日本人110例のLEMSをまとめたもので、日本人に関するデータはほとんどここから参照させていただきました。
・重症筋無力症/LEMS診療ガイドライン2022 日本神経学会 *2022/5/20日本神経学会学術総会後に追記